下列分子中,属于含有极性键的非极性分子
| A.CO2 | B.Cl2; | C.NH3; | D.H2O |
将7.28gFe溶于过量的稀H2SO4中,在加热的条件下,用2.02gKNO3去氧化溶液中Fe2+,待反应完全后,剩余Fe2+还需0.4mol/LKMnO4溶液25mL才能完全氧化,已知其反应方程式为:5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O。则KNO3的还原产物是
| A.N2O | B.NO | C.NO2 | D.N2O3 |
六种短周期元素A、B、C、D、E、F的原子序数依次增大,其中A与E同主族,B与F同主族,E与F同周期。已知常温下单质A与E的状态不同,D的核电荷数是B的最外层电子数的2倍,单质F是一种重要的半导体材料。则下列推断中正确的是
A.A、C两种元素可组成化学式为CA4的化合物
B.F与D形成的化合物性质很不活泼,不与任何酸反应
C.原子半径由大到小的顺序是E>F>C>D
D.元素的非金属性由强到弱的顺序是D>C>F>B
下列离子或分子组中能大量共存且满足相应要求的是
| 选项 |
离子 |
要求 |
| A |
K+、AlO、Cl-、MnO |
c(K+)<c(Cl-) |
| B |
Fe3+、NO、I-、HCO |
逐滴滴加盐酸立即有气体产生 |
| C |
NH、Al3+、SO、CH3COOH |
滴加NaOH溶液立刻有气体产生 |
| D |
Na+、Cu2+、Cl-、SO |
逐滴滴加氨水先有沉淀产生,后沉淀消失 |
工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下: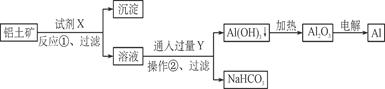
下列叙述正确的是
| A.试剂X可以是氢氧化钠溶液,也可以是盐酸 |
| B.反应①过滤后所得沉淀为氢氧化铁 |
| C.图中所示转化反应都不是氧化还原反应 |
| D.反应②的化学方程式为NaAlO2+CO2+2H2O===Al(OH)3↓+NaHCO3 |
下列各组物质的稀溶液相互反应,无论是前者滴入后者,还是后者滴入前者,反应现象相同的是
| A.Na2CO3和HCl | B.AlCl3和NaOH |
| C.NaAlO2和H2SO4 | D.NaHCO3和Ba(OH) 2 |