已知0.1 mol/L的碳酸氢钠溶液的pH为8.4,则下列说法正确的是
| A.加入少量NaOH固体,钠离子和碳酸根离子浓度均增大 |
B.将该溶液加水稀释,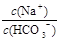 的比值保持不变 的比值保持不变 |
| C.c(Na+)+c(H+)=c(HCO3- )+c(CO32-)+c(OH-) |
| D.c(Na+)=c(HCO3- )+2c(CO32-)+c(H2CO3) |
根据碘与氢气反应的热化学方程式
(i) I2(g) H2(g)
H2(g) 2HI(g)
2HI(g) 9.48kJ
9.48kJ
(ii) I2(s) H2(g)
H2(g) 2HI(g)
2HI(g) 26.48kJ
26.48kJ
下列判断正确的是
| A.254g I2(g)中通入2g H2(g),反应放热9.48kJ |
| B.1mol固态碘与1mol气态碘所含的能量相差17.00kJ |
| C.反应(i)的产物比反应(ii)的产物稳定 |
| D.反应(ii)的反应物总能量比反应(i)的反应物总能量低 |
某一兴趣小组准备在实验室中制H2,装置如图所示。可是在实验室中发现酸液不足。为达到实验目的,则可以从长颈漏斗中加入下列试剂中的
| A.NaNO3溶液 | B.四氯化碳 | C.苯 | D.Na2CO3溶液 |
下列物质的制备线索中,不符合工业生产实际的是
A.NH3 NO NO HNO3 HNO3 |
B.浓缩海水 Br2 Br2 Br2(粗产品) Br2(粗产品) Br2 Br2 |
C.MnO2 Cl2 Cl2 漂白粉 漂白粉 |
D.石油 乙烯 乙烯 聚乙烯 聚乙烯 |
如图所示,集气瓶内充满某混合气体,置于光亮处一段时间后,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,则集气瓶内气体是
①CO、O2 ②C12、CH4 ③NO2、O2 ④N2、H2
| A.①② | B.②④ | C.②③ | D.③④ |
下列排列顺序不正确的是
| A.原子半径:Si>Na>O | B.热稳定性:HF>HCl>H2S |
| C.碱性:CsOH>KOH>NaOH | D.失电子能力:K>Na>Mg |