FeSO4?7H2O广泛用于医药和工业领域。
以下是FeSO4?7H2O的实验室制备流程图。
根据题意完成下列填空:
(1)碳酸钠溶液能除去酯类油污,是因为 (用离子方程式表示),反应Ⅰ需要加热数分钟,其原因是 。
(2)废铁屑中含氧化铁,无需在制备前除去,理由是
(用离子方程式回答) , 。
(3)判断反应Ⅱ完成的现象是: 。
以下是测定某补血剂(FeSO4?7H2O)中铁元素含量的流程图。根据题意完成下列填空: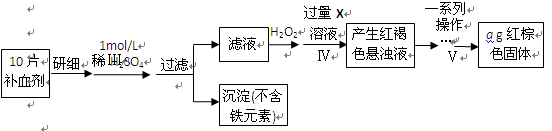
(4)步骤Ⅲ需要100mL1mol/L的稀硫酸,用98.3%,ρ=1.84g/cm3的浓硫酸配制,所用的仪器有量筒、烧杯、玻璃棒、胶头滴管及 。写出步骤Ⅳ的离子方程式: 。
(5)步骤Ⅴ一系列操作依次是:①过滤②洗涤③ ④冷却⑤称量⑥恒重操作。操作⑥的目的是 。
(6)假设实验无损耗,则每片补血剂含铁元素的质量 g(用含a的代数式表示)。
把在空气中久置的铝片5.0 g投入盛有 500mL0.5 mol·L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间可用如右的坐标曲线来表示,回答下列问题:
(1)曲线由0→a段不产生氢气的原因___________,
有关反应的离子方程式为____________;
(2)曲线由a→b段产生氢气的速率较慢的原因___________
有关的化学方程式__________________________;
(3)曲线由b→c段,产生氢气的速率增加较快的主要原因_________________________;
(4)曲线由c以后,产生氢气的速率逐渐下降的主要原因_________________________。
某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用下图所示装置进行有关实验。请回答下列问题:
(1)装置A中发生的化学反应方程式为___________________________。
在此反应中,浓硫酸所体现的主要性质是______(填序号)
A酸性 B强氧化性 C脱水性 D吸水性 E强腐蚀性 F不挥发性
(2)装置D中试管口放置的棉花中应浸一种液体,这种液体是_____________,其作用是_________________________。
(3)装置B的作用是贮存多余的气体。当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是。
B中应放置的液体是(填字母)__________________。
a.水 b.酸性KMnO4溶液 c.浓溴水 d.饱和NaHSO3溶液
取wg含有杂质(杂质受热不分解)的NH4HCO3,选用如图所示的装置,制取一瓶干燥的氨气,多余氨气全部被水吸收。回答:
(1)选用的装置是(用A、B、C……回答),连接选取装置的正确顺序是(a,b,c……填写):接;接;接。
(2)E装置中所盛药品的名称是,其作用是。
(3)若选用B装置,连接时b口进气还是C口进气,其原因是。
(4)若收集到氨气VmL(标准状况),氨水的浓度为a mol/L,则碳酸氢铵的纯度为
%(设NH4HCO3全部分解)。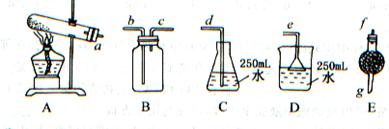
用一种试剂除去下列各气体中的杂质(括号内为杂质):
(1)CO2(SO2):试剂 ,离子方程式
(2)SO2(HCl):试剂 ,离子方程式
(14分)某研究性学习小组设计了如图所示的定量测定装置,其中B是底面积为100cm2、高20cm的圆筒状玻璃容器(带密封盖),上面标有以厘米为单位的刻度。其他夹持装置已略去。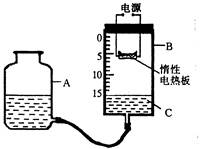
I.甲同学用这套装置测定出了空气中氧气的体积分数,他的操作过程是:
①检查装置的气密性;
②打开B容器密封盖,加入液体C,调整A的高度,使B中液面至刻度15.0cm处;
③将过量的铁粉平铺在电热板上,盖紧容器B的密封盖;
④通电加热铁粉,待充分反应后,冷却到原来的状况,调整A的高度使容器A、B中的液面保持水平,记录液面刻度。
请回答下列问题:
(1)在操作①中检查装置气密性的方法是__________________________ __。
(2)在该同学的实验中,下列物质不能用于代替铁粉的是______。
A.红磷 B.木炭 C.铜粉
(3)在操作④结束时,与装置B中的液面最接近的刻度是______cm(填整数)。
II.乙同学欲用此装置测定铁在氯气中燃烧产物的化学式。他的操作与甲不同之处有:将操作③中铁粉的质量改为1.0g,并使容器B充满氯气后,再盖紧容器。请回答下列问题:
(1)在乙同学的实验中,下列试剂中适合于做液体C的是_______。
A.水 B.氢氧化钠溶液 C.饱和食盐水
(2)实验结束时,液面在刻度8.8cm处。若将当时的实验条件近似看作标准状况,请据此计算生成物FeClx中x的值是______(计算结果保留1位小数)。
(3)上面的实验结果比理论值________(填“偏大”或“偏小”),误差产生的原因可能是____________________________________________________________。