已知,常温下,KSP(AgCl)=1.8×10-10 mol2·L-2,KSP(AgI)=8.3×10-17
mol2·L-2,下列叙述中,正确的是
| A.常温下,AgCl在饱和NaCl溶液中的KSP比在纯水中的KSP小 |
B.向AgCl的悬浊液中加入KI溶液,沉淀由白色转化为黄色 |
C.将0.001 mol·L-1的AgNO3溶液滴入KCl和KI的混合溶液中,一定先产生AgI沉淀 |
D.向AgCl的饱和溶液中加入NaCl晶体,有AgCl析出且溶液中c(Ag+)=c(Cl- |
A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的透明气球。关闭K2,将等量且少量的NO2通过K1、K3分别充入A、B中,反应起始时,A、B的体积相同。(已知:2NO2 N2O4△H<0)下列叙述正确的是
N2O4△H<0)下列叙述正确的是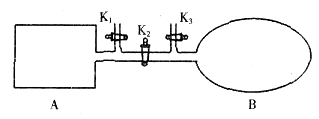
A. 到达平衡时A和B中NO2气体体积分数相同
B. 若在A、B中再充入与初始量相等的NO2,则达到平衡时A、B中NO2的转化率都增大
C. 若气球的体积不再改变,表明B中反应已达到平衡
D. 室温下,若设法使A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时B中气体的颜色较深
在不同温度下,水溶液中c(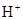 )与c(
)与c(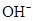 )有如图所示关系,下列有关说法正确的是
)有如图所示关系,下列有关说法正确的是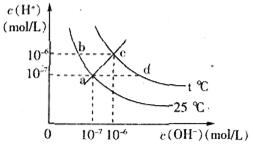
| A.c点对应的溶液中大量存在的离子可能为:Na+、Al3+、Cl-、CO32- |
| B.将25℃时的NaCl溶液加热到t℃,则该溶液中的c(OH-)由a点变化到b点 |
| C.t℃>25℃ |
| D.ac线上的任意一点均有pH=7 |
硫-钠原电池具有输出功率较高,循环寿命长等优点。其工作原理可表示为:2Na+xS Na2Sx。但工作温度过高是这种高性能电池的缺陷,科学家研究发现,采用多硫化合物(
Na2Sx。但工作温度过高是这种高性能电池的缺陷,科学家研究发现,采用多硫化合物(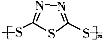 )作为电极反应材料,可有效地降低电池的工作温度,且原材料价廉、低毒,具有生物降解性。下列有关叙述正确的是
)作为电极反应材料,可有效地降低电池的工作温度,且原材料价廉、低毒,具有生物降解性。下列有关叙述正确的是
A.多硫化合物(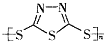 )是一种新型无机非金属材料 )是一种新型无机非金属材料 |
B.多硫化合物( )化合物不能发生加成反应 )化合物不能发生加成反应 |
C.原电池的负极反应是将单体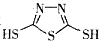 转化为 转化为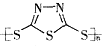 的过程 的过程 |
| D.当电路中有0.02mol电子通过时,原电池的负极将消耗原料0.46g |
关于工业转化图(见下图),下列说法不正确的是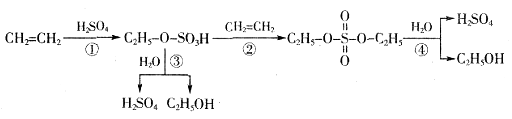
| A.该过程是一种“对环境友好型”工业生产硫酸的方法 |
| B.从以上物质的转化过程可看出硫酸可作乙烯水化法制乙醇的催化剂 |
| C.该过程中①②是加成反应 |
| D.该过程中③④是酯类的水解 |
下列除杂,所用试剂和操作均正确的是
| 选项 |
物质成分(括号内为杂质) |
所用试剂 |
操作 |
| A |
铁屑(油污) |
纯碱溶液 |
洗涤 |
| B |
苯(苯酚) |
溴水 |
过滤 |
| C |
碳酸钡(硫酸钡) |
盐酸 |
溶解、过滤 |
| D |
乙醇(乙酸) |
烧碱溶液 |
分液 |