蛇纹石可用于生产氢氧化镁,简要工艺流程如下:
I.制取粗硫酸镁:用酸液浸泡蛇纹石矿粉,过滤;并在常温常压下结晶,制得粗硫酸镁
(其中常含有少量Fe3+、Al3+、Fe2+等杂质离子)。
II.提纯粗硫酸镁:将粗硫酸镁在酸性条件下溶解,加入适量的0.1 mol/L H2O2溶液,再
调节溶液pH至7~8,并分离提纯。
III.制取氢氧化镁:向步骤II所得溶液中加入过量氨水。
已知:金属离子氢氧化物沉淀所需pH
| |
Fe3+ |
Al3+ |
Fe2+ |
Mg2+ |
| 开始沉淀时 |
1.5 |
3.3 |
6.5 |
9.4 |
| 沉淀完全时 |
3.7 |
5.2 |
9.7 |
12.4 |
请回答:
(1)步骤II中,可用于调节溶液pH至7~8的最佳试剂是 (填字母序号)。
A. MgO B. Na2CO3 C.蒸馏水
(2)工业上,常通过测定使铁氰化钾(K3[Fe(CN) 6])溶液不变色所需H2O2溶液的量来确
定粗硫酸镁中Fe2+的含量。已知,测定 123 g粗硫酸镁样品所消耗的0.1 mol/L H2O2
溶液的体积如下表所示。
| |
平行测定数据 |
平均值 |
|||
| 实验编号 |
1 |
2 |
3 |
4 |
|
| 消耗H2O2溶液的体积/mL |
0.32 |
0.30 |
0.30 |
0.32 |
0.31 |
Fe2+与H2O2溶液反应的离子方程式为 。
(3)工业上常以Mg2+的转化率为考察指标,确定步骤III制备氢
氧化镁工艺过程的适宜条件。其中,反应温度与Mg2+转化率
的关系如右图所示。
根据图中所示 50℃前温度与Mg2+转化率之间的关系,可判 断此反应是 (填“吸热”或“放热”)反应。
②图中,温度升高至 50℃以上Mg2+转化率下降的可能原因 是 。
③Ksp表示沉淀溶解平衡的平衡常数。已知:
Mg(OH)2(s)  Mg2+ (aq)+ 2OH- (aq) Ksp = c(Mg2+)·c2( OH-) = 5.6×10-12
Mg2+ (aq)+ 2OH- (aq) Ksp = c(Mg2+)·c2( OH-) = 5.6×10-12
Ca(OH)2(s) Ca2+ (aq) + 2OH- (aq) Ksp = c(Ca2+)·c2(OH-) = 4.7×10-6
Ca2+ (aq) + 2OH- (aq) Ksp = c(Ca2+)·c2(OH-) = 4.7×10-6
若用石灰乳替代氨水, (填“能”或“不能”)制得氢氧化镁,理由是 。
下列是中学化学中常见物质间的反应转化关系图,其中部分产物已略去。常温下,G为固体单质,B、I为液体,其余都为气体。A为化合物,I的浓溶液与G在加热条件下生成F、B和C。H可用作工业上冶炼金属的还原剂。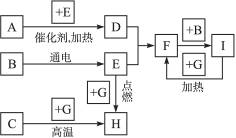
请按要求填空:
(1)写出下列物质的化学式:A______________,B____________,C____________。
(2)写出A→D的化学方程式________________________。
(3)写出G和I的浓溶液反应的化学方程式:________________________。
某无色透明溶液可能含有下列离子:K+、Al3+、Fe3+、Ba2+、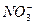 、
、 、
、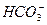 、Cl-等,取该溶液进行如下实验:
、Cl-等,取该溶液进行如下实验:
①用蓝色石蕊试纸检测该溶液,试纸显红色;
②取溶液少许,加入铜片和稀硫酸共热,产生无色气体,该气体遇到空气立即变为红棕色;
③取溶液少许,加入氨水有白色沉淀生成,继续加入过量氨水,沉淀不消失;
④取溶液少许,滴入氯化钡溶液产生白色沉淀;
⑤取实验④后的澄清溶液,滴入硝酸银溶液产生白色沉淀,再加入过量的稀硝酸,沉淀不消失。
请回答下列问题:
(1)在实验①中,下图所示的操作中正确的是________________(填代号)。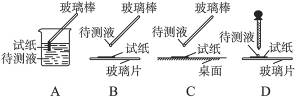
(2)根据上述实验判断原溶液中肯定存在的离子是______________________,肯定不存在的离子是___________________。
(3)写出与②和③两个实验有关的离子方程式:
②____________________________________________,
③____________________________________________。
(1)在浓硝酸中放入铜片。
①开始反应的化学方程式为__________________________________。
②若铜有剩余,则反应将要结束时的反应方程式是______________________________。
③等反应停止后,再加入少量25%的稀硫酸,这时铜片上又有气泡产生,其原因是
_______________________________________________________________________________。
(2)在100 mL混合酸中,c(HNO3)="0.4" mol·L-1,c(H2SO4)="0.2" mol·L-1,向其中加入2.56 g铜粉,微热,等充分反应后,溶液中Cu2+的物质的量浓度为__________________________。
(3)14 g铜银合金与一定量某浓度的硝酸溶液反应,将放出的气体与1.12 L(标准状况下)氧气混合通入水中,恰好全部被水吸收,则合金中铜的质量是_________________g。
GaAs是仅次于硅的一种新型化合物半导体材料,其性能比硅更优越。Ga位于周期表的第ⅢA族,As位于周期表的第ⅤA族。
(1)Ga和As的最外层电子数分别是_____________________________________________。
(2)GaAs中Ga和As的化合价分别是___________________________________________。
(3)第ⅣA族的C和Si也可以形成类似的化合物半导体材料,该化合物半导体材料的化学式可表示为__________________。
下图表示NH4NO3和D物质为初始反应物发生的一系列变化,其中,在常温下B为液态,F为不溶于水但可溶于酸的白色固体,G与I为无色气体,G能使湿润的红色石蕊试纸变蓝。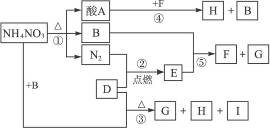
(1)D和H的化学式:D_____________,H_____________,G与E的电子式:G_____________, E_____________。
(2)写出下列反应的方程式:反应①_____________;反应②_____________。