设NA是阿伏加德罗常数的数值,下列说法正确的是
| A.常温下,23 g NO2含有NA个氧原子 |
| B.1 mol Cl2与足量的铁反应,转移的电子数为3NA |
| C.0.1 mol24Mg32S晶体中所含中子总数为2.8 NA |
| D.用惰性电极电解硫酸铜溶液,若生成1 mol O2,则转移电子数为2NA |
下图是一些重要工业生产的转化关系(反应条件略去):
请完成下列问题:
⑴若D是单质,且与A属于同一主族,则。
①反应的化学方程式是。
②D的原子结构示意图是。
③D单质的一种重要用途是。
⑵若B为黄色固体,D为固体化合物,则
①该反应的化学方程式是。
②生产该工业品的工厂应建在离较近的地方。
③实验室检验C的方法是。
⑶若C是一种有刺激性气味的气体,则
①C的分子形状是。
②实验室进行此实验时,常看到有大量白烟产生,请说明产生大量白烟的原因。
③化合物C在一定体积的容器中,在一定条件下发生反应,测得容器内气体的压强略小于原来的2/3,请写出该反应的化学方程式。
I.下图是中学教材中铜与稀硝酸反应的实验装置,请就此回答下列问题:
(1)管A中发生反应的离子方程式是。
⑵试管A中观察到的现象是。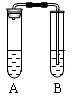
⑶试管B中盛装NaOH溶液的目的是。
II.上述装置存在明显的不足,为克服上述缺点,某课外小组的学生设计了如图所示的装置。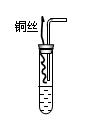
实验步骤如下:①检查装置的气密性;②向试管中加入一定量碳酸
钙固体;③向试管中加入过量稀硝酸,并迅速盖上带铜丝和导管的
橡皮塞;④待反应完全后,将导管插入试管内接近液面(如图);
⑤将铜丝插入到溶液中;⑥反应一段时间后,用注射器向试管内
推入氧气(或空气)。
请回答下列问题:
⑷实验中加入CaCO3的作用是。
⑸实验④的实验目的是。
⑹实验⑥中推入氧气或空气的目的是。
CH3CH2OH、CH3COOH和NaOH都是中学化学的常用试剂。请回答下列问题:
⑴①乙酸和甲酸甲酯互为同分异构体,但前者的熔点高于后者。原因是。
②在油脂的皂化反应中,加入乙醇能加快反应的速率。原因是。
③将在空气中灼烧成红热的铜丝伸入无水乙醇中,铜丝立即变为红色。请用化学方程式表示铜丝变红的原因。
⑵用0.1mol/LNaOH溶液测定CH3COOH的物质的量浓度,碱式滴定管用标准溶液润洗后即加入标准溶液,经“必要”操作后,进行滴定。
①此处的“必要”操作是指。
②选用的指示剂是。
③滴点终点时溶液中离子浓度由大到小的顺序是。
⑶无水醋酸钠和NaOH固体混合加热时能生成CH4,反应的化学方程式是,利用此反应制备CH4的装置与制备相同。
⑷乙醇和乙酸在浓硫酸存在下反应生成具有香味的物质,反应的化学方程式是。反应类型是,用浓硫酸作催化剂可能造成等问题(答两条即可)。
下图中,P为可自由滑动的活塞,关闭K,V(A)=aL,V(B)=0.8aL(连通管的体积忽略不计)。在相同温度和有催化剂存在的条件下,分别向容器A、B中各充入1molN2和3molH2,发生反应N2(g)+3H2(g)  2NH3(g);ΔH=-92.4kJ/mol。达到平衡后,V(B)=0.6aL。
2NH3(g);ΔH=-92.4kJ/mol。达到平衡后,V(B)=0.6aL。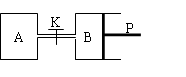
⑴B中N2的转化率是。A中N2的转化率(填“大于”、“等于”或“小于”)B中N2的转化率。理由是。
⑵打开K,一段时间后反应再次达到平衡,则B的体积为。请说明理由?
⑶A反应达到平衡时,放出akJ的热量,若向A中充入2molNH3,在相同条件下达到平衡时吸收热量为bkJ,则a和b的关系是。
⑷B中反应达到平衡后,只改变下列条件,c(NH3)不改变的是(填序号)。
A.升高温度 B.向容器充入1molAr(g)
C.向容器中充入2molNH3 D.选用效果更好的催化剂
为测定某CuO和Cu2O的混合物中CuO的质量[m(CuO)],实验中测得如下数据:
m—混合物的质量(g) m(H2O)—生成水的质量(g)
m(Cu)—生成铜的质量(g) V(H2)—消耗H2在标准状况下的体积(L)
为计算m(CuO),至少需要上述四个数据中的几个,它们的组合共有几种()
| A.2,5 | B.2,6 | C.3,5 | D.3,6 |