某学校研究性学习小组利用实验室常用试剂,
探究硝酸的氧化性。请完成下面的空白:
(1)在具支试管底部滴入5滴浓硝酸,然后用硫化 亚铁与盐酸反应制备H2S气体,如图所示通入具支试管中,可以观察到在试管内形成黄烟,黄烟附着在试管内壁上,形成“黄霜”。
出上述制备H2S的离子方程式
______________________________________。
②在试管内壁上的“黄霜”的成分是_______________,该反应说明浓硝酸有氧化性外,实验现象还说明了浓硝酸具有________性。该实验中烧杯内的氢氧化钠溶液的作用是
__________________________________________________________________。
(2)卤族元素单质也具有氧化性,该小组设计了下面的实验探究碘单质与稀硝酸氧化性强弱比较:
①提出合理的假设
假设l:碘单质氧化性强于稀硝酸;假设2:碘单质氧化性弱于稀硝酸。
②设计实验方案,进行实验探究,请写出实验步骤和预期的现象与结论。限选实验试剂与仪器:稀硝酸、KI溶液、四氯化碳;试管、胶头滴管。
运用甲烷自热来制取氢气是目前较为先进的技术。其涉及的反应如下:
①CH4(g)+2H2O(g)=CO2(g)+4H2(g) △H1=+165.0 kJ/mol反应活化能Ea1="243.9" kJ/mol
②CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H2=-802.6 kJ/mol反应活化能Ea2="125.6" kJ/mol
(1)2H2(g) + O2(g)= 2H2O(g)△H3= kJ/mol;
(2)下面能正确表示氢气和氧气反应生成水的能量变化示意图的是(填字母序号)。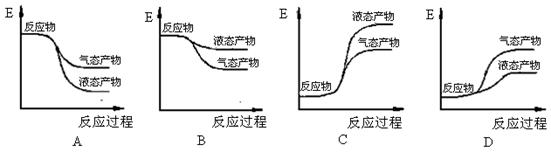
(3)运用甲烷自热来制取氢气是目前较为先进的技术。在同一反应系统同时通入甲烷、氧气和水蒸气,发生如上反应①和反应②,则反应开始时,反应①的反应速率反应②的反应速率(填“>”、“<”或“=”),理由是;从能量角度分析,在该制氢过程中通入适量氧气发生反应②的目的是;
已知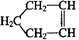 可简写为
可简写为 ,降冰片烯的分子结构可表示为:
,降冰片烯的分子结构可表示为: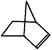
(1)降冰片烯属于。
A.环烃B.不饱和烃C.烷烃D.芳香烃
(2)降冰片烯的分子式为。
(3)降冰片烯与溴水反应的化学方程式为。
(4)降冰片烯不具有的性质
A.能溶于水B.能发生氧化反应
C.能发生加成反应D.常温常压下为气体
(5)降冰片烯的一种同分异构体(含有一个六元环的单环化合物)的结构简式为。
(6分)在某温度下,取一定质量的CuSO4溶液,用石墨做电极进行电解,当阳极产生标准状况下气体1.12 L时,CuSO4恰好被完全电解,得到密度为1.2 g/cm3的溶液200 mL。求:
(1)电解后,所得溶液的pH=。
(2)电解前,所取CuSO4溶液的质量为。
(3)若要使电解后所得溶液恢复至电解前的原始状态,需要加入质量为。
(6分)现有浓度为0.1 mol·L-1的五种电解质溶液①Na2CO3;②NaHCO3;③NaAlO2;④CH3COONa;⑤NaOH,已知:CO2+3H2O+2AlO2-= 2Al(OH)3↓+CO32-
(1)这五种溶液的pH由小到大的顺序是:(填编号);
(2)在上述五种溶液中分别加入AlCl3溶液,能产生大量无色无味气体的是:(填编号);
(3)将上述①、②、③、④四种溶液两两混合时,有一对溶液相互间能发生反应,写出该反应的离子方程式:。
(10分)化学电池是将化学能转变成电能的装置,包括一次电池、二次电池和燃料电池等几大类。燃料电池是目前正在探索的一种新型电池,已经使用的氢氧燃料电池的基本反应是:
X极:O2+2H2O+4e-=4OH- Y极:2H2+4OH—=4H2O+4e- 请回答下列问题 :
(1)X是极;Y极发生反应(填“氧化”或“还原”)
(2)该电池总反应方程式为
(3)若反应后的得到5.4 g液态水,此时氢氧燃料电池转移的电子数为。
(4)实验室用铅蓄电池作电源电解饱和食盐水,若制得Cl20.30 mol,电池内至少消耗H2SO4mol。