鲨鱼是世界上唯一不患癌症的动物,因其体内含有一种角鲨烯,具有抗癌性。该分子中含有30个碳原子及6个C=C键,且不含环状结构,则其分子式为( )
| A.C30H60 | B.C30H56 | C.C30H52 | D.C30H50 |
运用盖斯定律可方便地计算出难以通过实验直接测定的反应热。已知:
①P4(白磷,s)+5O2(g)=P4O10(s) ΔH=-2983.2kJ·mol-1
②P(红磷,s)+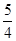 O2(g)=
O2(g)=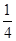 P4O10(s) ΔH=-738.5kJ·mol-1
P4O10(s) ΔH=-738.5kJ·mol-1
则白磷转化为红磷的热化学方程式为
| A.P4(白磷,s)=4P(红磷,s) △H=-29.2kJ·mol-1 |
| B.P4(白磷,s)=4P(红磷,s) △H=+29.2kJ·mol-1 |
| C.P4(白磷,s)=4P(红磷,s) △H=-2244.7kJ·mol-1 |
| D.P4(白磷,s)=4P(红磷,s) △H=+2244.7kJ·mol-1 |
第三周期元素X、Y、Z可分别形成Xn+、Ym+、Zn-三种离子,已知m>n,且三种元素相应的最高价氧化物对应水化物两两之间会发生反应。下列说法中不正确的是
| A.Y为Al |
| B.Z的最高价氧化物对应水化物的分子式为HClO4 |
| C.X与Z结合形成离子化合物 |
| D.X、Y、Z原子半径Z>X>Y |
NA为阿伏加德罗常数,下列叙述正确的是
| A.1L 0.5mol·L-1氨水中所含NH4+数为0.5NA |
| B.1mol Fe与足量氯气反应转移的电子数为2 NA |
| C.标准状况下,33.6L CO2约含有1.5NA个分子 |
D.1 mol 中含碳碳双键数为3 NA 中含碳碳双键数为3 NA |
H2S2O3是一种弱酸,实验室欲用0.01 mol·L-1的Na2S2O3溶液滴定I2溶液,发生的反应为I2+2Na2S2O3 =2NaI+Na2S4O6,下列说法合理的是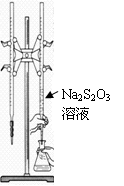
| A.该滴定可用甲基橙做指示剂 |
| B.Na2S2O3是该反应的还原剂 |
| C.该滴定可选用右图所示装置 |
| D.该反应中每消耗2mol Na2S2O3,电子转移数为4mol |
下列离子方程式正确的是
| A.醋酸溶解鸡蛋壳:2H++ CO32-==CO2↑+ H2O |
| B.铝片加入烧碱溶液:2A1+ 2OH—+ 2H2O==2A1O2—+ 3H2↑ |
| C.铁与盐酸反应:2Fe+ 6H+== 2Fe3+ + 3H2↑ |
| D.铜片投入FeCl3溶液中:Cu+ Fe3+==Cu2+ + Fe2+ |