某校化学研究性学习小组的同学在学习了氨的性质持讨论:运用类比的思想,既然氨气具有还原性,能否像H2那样还原CuO呢?他们设计实验制取氨气并探究上述问题。请你参与该小组的活动并完成下列研究:
(一)制取氨气
(1)写出实验制取氨气的化学方程式 ;
(2)在实验室中,还可以用浓氨水与 (填写一种试剂)快速制取少量氨气;
(3)有同学模仿排饱和食盐水收集氯气的方法,想用排饱和氯化铵溶液的方法收集氨气。你认为能否达到目的? (填“能”或“否”),理由是 。
(二)该小组中某同学设计了下图所示的实验装置(夹持及尾气处理装置未画出),探究氨气的还原性:

(1)该装置在设计上有一定缺陷,为保证实验结果的准确性,对该装置的改进措施是 。
(2)利用改进后的装置进行实验,观察到CuO变为红色物质,无水CuSO4变蓝色,同时生成一种无污染的气体。写出氨气与CuO反应的化学方程式: 。
(三)问题讨论
(1)有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O。已知:Cu2O是一种碱性氧化物;在酸性溶液中,Cu+的稳定性比Cu2+差(Cu+ Cu+Cu2+)。请你设计一个简单的实验检验该红色物质中是否含有Cu2O。
Cu+Cu2+)。请你设计一个简单的实验检验该红色物质中是否含有Cu2O。
。
(2)在解决了问题(1)后,又有同学提出:Cu2O与CuO的热稳定性哪个更强?于是他们进行了如下实验:取98 gCu(OH)2固体,加热至80℃~100℃时,得到黑色固体粉末,继续加热到1000℃以上,黑色粉末全部变为红色粉末A。冷却后称量,A的质量为72g。据此可推得,A的化学式为 。由此,得到的结论是
。
水蒸气通过灼热焦炭后,流出气体主要是CO和H2,还有CO2和水蒸气等。请用下图中仪器,选择必要的试剂,设计实验证明上述混合气体中有CO和H2。(加热装置和导管等在图中略去)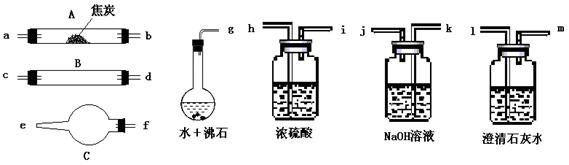
⑴盛浓硫酸的装置的用途是___________;盛NaOH溶液的装置的用途是___________。
⑵仪器B中需加入试剂的名称是 ,所发生反应的化学方程是
、。
⑶仪器C中加试剂的化学式是,其目的是。
⑷按气流方向连接各仪器,用字母表示接口的连接顺序:g-ab 。
。
⑸能证明混合气中含有CO的实验依据是。
能证明混合气中含H2的实验依据。
阅读、分析下列两个材料:
材料一: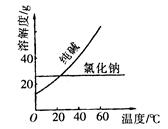
材料二:
| 物质 |
熔点/℃ |
沸点/℃ |
密度/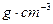 |
溶解性 |
| 乙二醇 (C2H6O2) |
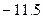 |
198 |
1.11 |
易溶于水和乙醇 |
| 丙三醇 (C3H8O3) |
17.9 |
290 |
1.26 |
能跟水、酒精以任意比互溶 |
回答下列问题(填序号):
A. 蒸馏法 B. 萃取法 C. “溶解、结晶、过滤”的方法 D. 分液法
①将纯碱从氯化钠和纯碱的混合物中分离出来,最好应用。
②将乙二醇和丙三醇相互分离的最佳方法是。
用18 mol/L H2SO4配制100 mL 1.0mol/L H2SO4,若实验仪器有A.100m L 量筒 B.托盘天平 C.玻璃棒 D.50m L容量瓶 E.10m L量筒 F.胶头滴管 G.50m L烧杯 H.100m L 容量瓶
(Ⅰ)实验时选用的仪器有(填序号)________________________配制过程中,下列情况会使配制结果偏高的是(填序号)_______。
①定容时俯视刻度线观察液面
②容量瓶使用时未干燥
③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度
(Ⅱ)在容量瓶使用方法中,下列操作不正确的是(填序号)_______________
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再 用待配液润洗
用待配液润洗
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近刻度线1~2㎝处,再改用胶头滴管加蒸馏水到刻度线
D.配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水到接近刻度线线1~2㎝处,再改用胶头滴管加蒸馏水到刻度线
E.盖好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀
实验室需要0.1 mol/L NaOH溶液450 mL根据计算用托盘天平称取NaOH的质量为g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度0.1 mol/L
(填“大于”、“等于”或“小于”,下同)。若NaOH在溶解后未冷却到室温,便注入容量瓶内并将洗涤液一并转移到容量瓶,并定容,则所得溶液浓度0.1 mol/L。
某溶液中只含有Na2SO4、Na2CO3和NaCl三种溶质。欲证明其中SO42-、CO32-、Cl- 三种阴离子确实存在,我们设计了如下实验,请你认真填写下面的实验报告。
| 实验步骤 |
实验现象 |
结论 |
1、向盛放溶液的试管中加入足量。 |
有气泡产生 |
证明有CO32- |
 2、继续向试管中加入足量溶液 |
有白色沉淀生成 |
证明有。 |
3、过滤,向滤液中加适量的溶液 |
有白色沉淀生成 |
证明有  。 。 |