近年来,江苏省酸雨污染较为严重,防治酸雨成了迫在眉睫的问题。
⑴有人提出了一种利用氯碱工业产品治理含二氧化硫废气的方法,流程如下:
(Ⅰ)将含SO2的废气通入电解饱和食盐水所得溶液中,得NaHSO3溶液。(Ⅱ)将电解饱和食盐水所得气体反应后制得盐酸。(III)将盐酸加入NaHSO3溶液中得SO2气体回收,生成的NaCl循环利用。
写出步骤(I)反应的化学方程式:
写出步骤(Ⅱ)中电解饱和食盐水的化学方程式:
③写出步骤(III)反应的离子方程式:
⑵还有学者提出利用 Fe 2十、Fe3十等离子的催化作用,常温下将SO2氧化成SO42一而实现SO2的回收利用。某研究性学习小组据此设计了如下方案,在实验室条件下测定转化器中SO2氧化成SO42一的转化率。

①该小组采用下图装置在实验室测定模拟烟气中SO2的体积分数,X溶液可以是 。(填写序号)
| A.碘的淀粉溶液 | B.酸性高锰酸钾溶液 |
| C.氢氧化钠溶液 | D.氯化钡溶液 |
②若上述实验是在标准状况下进行的,欲测定转化器中SO2氧化成SO42一的转化率,已知气体流速,还需测定的数据有 、 。
(Ⅰ)溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物。
(1)写出溴乙烷在NaOH水溶液中的反应方程式:
反应类型。某同学取少量溴乙烷与NaOH水溶液反应后的混合溶液,向其中滴加AgNO3溶液,加热,产生少量沉淀。该同学由此得出溴乙烷与NaOH水溶液反应,生成了溴化钠,你认为是否合理,原因:。
(2)写出溴乙烷在NaOH乙醇溶液中的反应方程式反应类型。反应中生成的气体可以用下图所示装置检验,现象是,水的作用是。除高锰酸钾酸性溶液外,还可以用检验生成的气体,此时还有必要将气体先通入水中吗?(填“有”或“没有”) 
(Ⅱ)下面是实验室制乙烯并检验其性质的装置图,请回答:
(1)写出圆底烧瓶中反应的方程式,
反应类型_______________;
(2)烧瓶中混合液逐渐变黑,并产生某些无机杂质气体,写出产生杂质气体的化学方程式:
;
(3)为了检验乙烯的生成,试管中应盛放,
现象为;
(4)洗瓶中盛放的试剂为,作用________________________________。
(Ⅲ)某学习小组同学为了确定盐酸 、苯酚、碳酸的酸性强弱,设计了如图所示的装置图进行实验:
(1)锥形瓶内装某可溶性盐,写出A中反应的离子方程式:
;
(2)C中的现象为,写出C中反应的化学方程式:_____________;
(3)B中的试剂为,作用。
(I) 电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。用FeCl3溶液做腐蚀液与Cu反应生成CuCl2和FeCl2。
(1) 写出该反应的化学方程式。
(2) 检验溶液中Fe3+存在的试剂是,证明Fe3+存在的现象是。
(Ⅱ) 印刷电路的废腐蚀液含有大量CuCl2、FeCl2、FeCl3,任意排放会造成环境污染及资源的浪费。通过下列流程可从该废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用。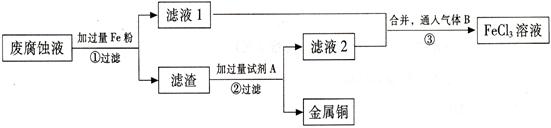
⑴ 步骤①中发生反应的离子方程式。
(2) 步骤②需加入的试剂A是(填化学式)。
(3) 步骤③通入的气体B是(填化学式),写出该反应的化学方程式。
(4) 为测定滤渣中铜的质量分数,取50g的滤渣与足量的试剂A反应,得到5.6L气体(标准状况下),试计算滤渣中铜的质量分数。
混合物A中含有KAl(SO4)2·12H2O、Al2O3和Fe2O3,通过下图所示方法可分离回收Al2O3和Fe2O3:
回答下列问题:
(1) 滤渣Ⅰ的主要成分是(填化学式)。
(2) 为了使滤渣Ⅰ中某些成分溶解,便于分离出Fe2O3,所加入的试剂Ⅰ是(填化学式),发生反应的离子方程式是:。
(3) 向滤液Ⅰ中加入过量氨水可得到白色沉淀,反应的离子方程式是:。
(4) 滤渣Ⅲ的主要成分是(填化学式);滤渣Ⅲ在一定条件下反应生成 Al2O3,反应的化学方程式是。
某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应)。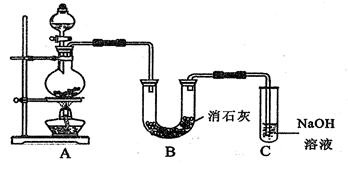
据此回答下列问题:
(1) 在A装置中用固体二氧化锰与浓盐酸在加热条件下制取氯气,若在标准状态下收集到33.6L的氯气,则被氧化的HCl的物质的量是。
(2) 漂白粉将在U形管中产生,其化学方程式是。
(3) C装置的作用是。
(4) 此实验所得漂白粉的有效成分偏低。该学生经分析并查阅资料发现,主要原因是在U
形管中还存在两个副反应。
①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措
施是。
② 试判断另一个副反应为(用化学方程式表示)。
为避免此副反应的发生,可将装置作何改进。
(5) 家庭中使用漂白粉时,为了增强漂白能力,可加入少量的物质是( )
| A.食盐 | B.食醋 | C.烧碱 | D.纯碱 |
氯气是一种重要的化工原料,在生产和生活中的应用十分广泛。
(1)请写出实验室用二氧化锰和浓盐酸共热制取氯气的化学方程式。
(2)实验室欲制得氯气1.12 L,理论上需要消耗二氧化锰多少克?
(3)①若用3.36 L 氯气与4.0 mol/L的NaOH溶液反应制取简易消毒液,则需要多少毫升这种NaOH溶液能与氯气恰好完全反应?
②实验发现,该反应产物的质量明显小于理论值,可能的原因是
。