在通常情况下能大量共存,并且可以用浓硫酸干燥的一组气体是 ( )
| A.SO2、H2S、O2 | B.CO、H2、Cl2 |
| C.NO、H2、O2 | D.HCl、CO、NH3 |
图甲池和乙池中的四个电极都是惰性材料,请根据图示判断下列说法正确的是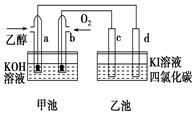
| A.两个装置之间没有盐桥,故不能形成电流 |
| B.a电极的电极反应式C2H5OH+16OH--12e-= 2CO+11H2O |
| C.一段时间后,乙池d电极周围的溶液呈现棕褐色 |
| D.乙池在反应前后溶液的pH不变 |
在一定体积pH = 12的Ba(OH)2溶液中,逐滴加入pH = 2的NaHSO4溶液,当溶液的pH 恰好为7时,则参加反应的Ba(OH)2溶液与NaHSO4溶液的体积比是
| A.1∶9 | B.1∶1 | C.1∶2 | D.1∶4 |
在由水电离产生的c(H+)=1×10–14mol/L的溶液中,一定可以大量共存的离子组是
| A.K+、Ba2+、Cl–、NO3– | B.Na+、Ca2+、I–、NO3– |
| C.NH4+、Al3+、Br–、SO42– | D.K+、Na+、HCO3–、SO42– |
氨水有下列平衡:NH3·H2O NH4+ + OH–当其它条件不变时,改变下列条件,平衡向左移动,且c(NH4+)增大的是
NH4+ + OH–当其它条件不变时,改变下列条件,平衡向左移动,且c(NH4+)增大的是
| A.加NaOH | B.加盐酸 | C.加NH4Cl | D.加热 |
未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是:①天然气②太阳能③风能④石油⑤煤⑥生物质能⑦核能⑧氢能
| A.①②③④ | B.②③⑥⑧ | C.①②⑤⑥⑦⑧ | D.③④⑤⑥⑦⑧ |