利用氧化还原反应原理配平
⑴ NH3 + Cl2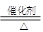 N2 + NH4Cl
N2 + NH4Cl
⑵ FeSO4 + KNO3 + H2SO4 = K2SO4 + Fe2(SO4)3 + NO↑+ H2O
在(2)的反应中 元素被氧化, 是还原产物,该反应中体现硫酸的 性。当反应中有0.3mol电子发生转移时,生成NO的体积(标准状况) L。
不用其它试剂,用最简单的方法鉴别下列物质:①NaOH溶液,②Mg(NO3)2溶液,③CuSO4溶液,④KCl溶液,正确的鉴别顺序是()
| A.①②③④ | B.③④②① | C.④①②③ | D.③①②④ |
在含有Cu(NO3)2、Mg(NO3)2、AgNO3的溶液中加入适量锌粉,首先被置换出的是()
| A.Mg | B.Cu | C.Ag | D.H2 |
下列反应的离子方程式正确的是()
①碳酸钙跟醋酸反应:CaCO3+2H+=Ca2++CO2↑+H2O
②铁跟稀盐酸反应:Fe+2H+=Fe2++H2↑
③碘化钾溶液跟适量溴水反应:I-+Br2=2Br-+I
④铁跟硫酸铜反应:Cu2++Fe=Fe2++Cu
⑤碳酸氢钙溶液跟足量烧碱溶液反应:Ca2++HCO3-+OH-=CaCO3↓+H2O
| A.①② | B.②⑤ | C.③④ | D.②④ |
NaOH、Na2CO3、NaCl、Na2SO4可按某种标准划为同一类物质,下列分类标准不正确的是()
| A.钠的化合物 | B.可与硝酸反应 | C.可溶于水 | D.电解质 |
相同物质的量浓度的NaCl、MgCl2、AlCl3三种溶液的体积比是1:1:1,则三种溶液中氯离子的物质的量之比为 ()
| A.1 :2 :3 | B.3 :2 :1 | C.1 :1 :1 | D.6 :3 :2 |