在一支25ml的酸式滴定管中盛入0.1 mol·L-1HCl溶液,其液面恰好在5 mL的刻度处,若把滴定管中的溶液全部放入烧杯中,然后以0.l mol·L-1NaOH溶液进行中和,则所需NaOH溶液的体积
| A.大于20 mL | B.小于20 mL | C.等于20 mL | D.等于5mL |
对常温下pH=3的CH3COOH溶液,下列叙述不正确的是
A.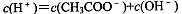 |
| B.加入少量CH3COONa固体后,c(CH3COO—)降低 |
| C.该溶液中由水电离出的c(H+)是1.0×10-11 mol/L |
| D.与等体积pH =11的NaOH溶液混合后所得溶液显酸性 |
下列与生活相关的叙述错误的是
| A.酸性臭氧水(AOW)可用于消灭HlNl病毒,因为臭氧具有强氧化性 |
| B.水的处理常用到漂白粉和明矾,二者的作用原理相同 |
| C.二氧化硫、氮氧化物以及可吸入颗粒物这三项是雾霾主要组成 |
| D.地沟油的主要成分是油脂,其组成与汽油、煤油不相同 |
Q、W、X、Y、Z是原子序数依次增大的短周期元素,X的焰色反应呈黄色。Q元素的原子最外层电子数是其内层电子数的2倍。W、Z最外层电子数相同,Z的核电荷数是W的2倍。元素Y的合金是日常生活中使用广泛的金属材料之一,下列说法正确的是( )
| A.氢化物稳定性:Z>W |
| B.原子半径的大小顺序:rX>rY>rQ>rW |
| C.元素Q和Z能形成QZ2型的共价化合物 |
| D.X、Y的最高价氧化物的水化物之间不能发生反应 |
下列离子方程式正确的是( )
| A.过氧化钠和水反应:2Na2O2+2H2O=4Na++4 OH—+O2↑ |
| B.用铜为电极电解饱和食盐水:2Cl—+2H2O通电Cl2↑+H2↑+2OH— |
| C.在明矾溶液中滴加过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+ |
| D.向小苏打溶液中加少量Ba(OH)2溶液:HCO3-+Ba2++OH-=BaCO3↓+H2O |
设NA为阿伏加德罗常数的值。下列说法正确的是( )
| A.25℃时,pH=13的氨水中含有OH-的数目为0.1NA |
| B.1 mol Na被完全氧化生成Na2O2,转移电子的数目为NA |
| C.标准状况下,2.24 LNO2与水反应生成NO3-的数目为0.1NA |
| D.4.0 g H2与足量N2完全反应生成NH3,反应中断裂共价键的总数为2NA |