下列离子方程式正确的是( )
| A.过氧化钠和水反应:2Na2O2+2H2O=4Na++4 OH—+O2↑ |
| B.用铜为电极电解饱和食盐水:2Cl—+2H2O通电Cl2↑+H2↑+2OH— |
| C.在明矾溶液中滴加过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+ |
| D.向小苏打溶液中加少量Ba(OH)2溶液:HCO3-+Ba2++OH-=BaCO3↓+H2O |
把铝粉与Fe3O4的混合物,分为两等份。前一份在高温下恰好完全反应,之后将生成物与足量盐酸充分反应;后一份直接加入足量NaOH溶液充分反应。前后两种情况下生成的气体在同温同压下的体积比是()
| A.4:3 | B.3:4 | C.9:8 | D.1:1 |
室温下,将一定质 量的镁、铜合金加入到稀硝酸中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3mol/LNaOH溶液至
量的镁、铜合金加入到稀硝酸中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3mol/LNaOH溶液至 沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g,则下列有关叙述中正确的是()
沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g,则下列有关叙述中正确的是()
| A.溶解合金时收集到NO气体的体积为2.24L |
B.参加反应的硝酸的物 质的量为0.1mol 质的量为0.1mol |
C.沉淀完全时消耗NaOH 溶液的体积为150mL 溶液的体积为150mL |
| D.加入合金的质量可能为6.4g |
已知,Fe2+结合S2—的能力大于结合OH—的能力,而Al3+则正好相反,I2的氧化性比S强。在Fe2(SO4)3和AlCl3的混合溶液中,先加入过量的KI溶液,再加入足量的Na2S溶液,所得沉淀是()
| A.FeS、Al(OH)3和S | B.Fe(OH)3和Al(OH)3 |
| C.Fe2S3和 Al(OH)3 | D.Al2S3、FeS和S |
下列各组物质的无色溶液,不用其它试剂即可鉴别的是()
①KOH Na2SO4 AlCl3②NaHCO3 NaNO3 H2SO4
③HCl NaAlO2NaCl④Ca(OH)2 Na2CO3 BaCl2
| A.①③ | B.②③ | C.①④ | D.①② |
用铁丝(电极a)、铜丝(电极b)和CuSO4溶液可以构成原电池或电解池,如右图所示。则下列说法正确的是()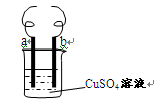
| A.构成原电池时b极反应为: Cu﹣2e—=Cu2+ |
| B.构成电解池时a极质量一定减少 |
| C.构成电解池时b 极质量可能减少也可能增加 |
| D.构成的原电池或电解池工作后就可能产生大量气体 |