(一)铝是生活中非常常见的一种金属,运用所学知识回答:
(1)金属铝是活泼的金属,但在生活中应用很广泛,原因是 。
(2)铝盐或铁盐能用于净水,是因为铝盐或铁盐在水溶液中形成了 。
(3)铝粉与氧化铁粉末在高温下得到铁的反应叫做“铝热反应”,发生反应的化学方程式为 。
(二)有一种褐铁矿主要成分是Fe2O3,所含杂质不溶于水和酸。某研究性学习小组的同学们利用一小块样品,设计实验证明矿物样品中有Fe3+。
实验用品:研钵、烧杯、玻璃棒、漏斗、铁架台、滤纸、试管、胶头滴管
(4)简述实验操作步骤、现象和结论。
在如下图所示的有关物质转化关系中,各物质均是我们中学化学所学的物质。C为一种黑色粉末,D为一种气体。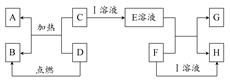
请根据框图中物质的转化关系及相关信息,用化学式填写下列空白:
(1)若F为可溶性碱,G为蓝色沉淀,则A为;D可能为。
(2)若G为蓝色沉淀,H为难溶性盐,则I为。
(3)若G、H都属于盐,且G为蓝色溶液,则I可能为;F可能为。
以下是依据一定的分类标准,对某些物质与水反应情况进行分类的分类图。请根据你所学的知识,按要求填空: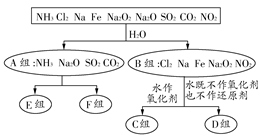
(1)上述第一级分类标准(分成A、B组所依据)是。
(2)C组物质为。
(3)D组物质中,与水反应时氧化剂和还原剂的物质的量之比为1:1的物质是(填化学式)。
(4)若E组和F组均有两种物质,则其分类依据是。
在建国60周年阅兵仪式上,我国展示的歼10、歼11等新型飞机,大展国威,为我们的平安生活筑起了新的“万里长城”,新型武器中离不开新材料的使用。请完成下列问题:
(1)下列说法不正确的是。
A.飞机机身材料(镁铝合金)经过抗氧化处理,能有效防止腐蚀
B.飞机中的导线外层可能由PVC材料制成
C.碳纤维材料可用于制造大型飞机通讯设备的外壳
D.飞机使用的机舱玻璃可由玻璃钢制成
(2)飞机上使用的某复合材料的基体是氮化硅陶瓷,增强体是SiO2纤维。
对该复合材料的说法正确的是。
A.该复合材料性质很稳定,不会溶解在任何酸中
B.氮化硅的化学式为Si3N4
C.该复合材料耐高温,强度高,导电导热性好,不易老化,可用于制造精密电子仪器
D.该复合材料与玻璃钢性能相似
(3)无氧铜是用于制造飞机所需真空电子器件的重要材料,但是无氧铜含氧超标会造成真空电子构件不合格,这仍是国际上的技术难题。一般所说的铜中含氧,实际上指的是含有Cu2O。某化学兴趣小组对一份铜样品展开探究(已知:Cu2O与Cu均为红色固体,酸性条件下能发生反应:Cu2O+2H+=Cu+Cu2++H2O)。
甲同学取少量该红色试样溶于过量的稀硝酸;乙同学取少量该红色试样溶于过量的稀硫酸。甲、乙的实验中能判断样品中是否含有Cu2O的是。甲同学的实验现象是。
铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式:。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、
负极,并写出电极反应式。
正极反应:。
负极反应:。
(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10 mol·L-1,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤。
| 氢氧化物开始沉淀时的pH |
氢氧化物沉淀 完全时的pH |
|
| Fe3+ Fe2+ |
1.9 7.0 |
3.2 9.0 |
| Cu2+ |
4.7 |
6.7 |
| 提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu |
(4)某科研人员发现劣质不锈钢在酸中腐蚀缓慢,但在某些盐溶液中腐蚀现象明显。请从上表提供的药品中选择两种(水可任选),设计最佳实验,验证劣质不锈钢易被腐蚀。有关反应的化学方程式;;劣质不锈钢腐蚀的实验现象。
下面是新设的一组垃圾箱的说明:
| 厦门市生活垃圾分类 |
||
| 可回收垃圾 |
不可回收垃圾 |
有害垃圾 |
| 1.纸类 2.玻璃 3.金属 4.塑料 5.橡胶 6.纺织品 |
1.厨房垃圾 2.灰土 3.杂草 4.枯枝 5.花卉 |
1.日光灯管 2.电池 3.喷雾罐 4.指甲油瓶 5.药品药瓶 6.涂改液瓶 |
(1)小明在整理房间时,清理出如下物品,它们应分别放入哪个垃圾箱(请填序号):
A废作业本;B汽水易拉罐;C生锈铁钉;D矿泉水瓶;E烂苹果;F涂改液瓶
应放入“可回收垃圾箱”的是;
应放入“不可回收垃圾箱”的是;
应放入“有害垃圾箱”的是。
(2)小明用盐酸除去铁钉上的锈(主要成分为氧化铁),以重新使用它,请写出盐酸除锈的化学方程式:。
(3)废铜有两种回收方法:
方法一:Cu+4HNO3=Cu(NO3)2+2X↑+2H2O(X是一种大气污染物)
方法二:铜在空气中加热生成氧化铜,氧化铜再与盐酸反应生成氯化铜和水。
方法一中,X的化学式为;方法二的优点是;
②请写出从氯化铜溶液中提取铜的化学方程式:;
该反应属于化学反应的基本类型是。
(4)请从可回收垃圾的类别中,举例说说化学的研究成果给社会进步带来的贡献:。