下表是某食品包装袋上的说明:
| 品名 |
浓缩菠萝汁 |
| 配料 |
水、浓缩菠萝汁、蔗糖、柠檬酸、黄原胶、甜蜜素、维生素C、菠萝香精、柠檬黄、日落黄、山梨酸钾等 |
| 果汁含量 |
≥80% |
| 生产日期 |
标于包装袋封口上 |
从表中的配料中分别选出一种物质填在相应的横线上。其中属于着色剂的有__________,属于调味剂的有__________,属于防腐剂的有__________,属于营养强化剂的有__________。
冰毒(化学名:甲基苯丙胺。苯环上有1个取代基)属于芳香族化合物,分子中只含有碳、氢、氮3种元素,相对分子质量不超过150,碳 元素和氢元素质量分数之和为90.6%。请按要求填空:
元素和氢元素质量分数之和为90.6%。请按要求填空:
(1)冰毒的摩尔质量为:_______________ _____;分子式为:____________________。
_____;分子式为:____________________。
(2)冰毒的同分异构体有很多,写出同时符合下列三项要求的冰毒同分异构体的结构简式
______________________________、______________________________(写出其中的2种)
①苯环上只含有两个相邻的取代基
②分子中含有氨基(-NH2)
③分子中含有两个甲基(-CH3)
异丙苯(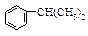 ),是一种重要的有机化工原料。根据题意完成下列填空:
),是一种重要的有机化工原料。根据题意完成下列填空:
(1)由苯与2-丙醇反应制备异丙苯属于__________反应;由异丙苯制备对溴异丙苯的反应试剂和反应条件 为__________________________________________________。
为__________________________________________________。
(2)异丙苯有多种同分异构体,其中一溴代物最少的芳香烃的结构简式是
______________________________。
(3)α-甲基苯乙烯(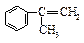 )是生产耐热型ABS树脂的一种单体,工业上由异丙苯催化脱氢得到。写出由异丙苯制取该单体的化学反应方程式:
)是生产耐热型ABS树脂的一种单体,工业上由异丙苯催化脱氢得到。写出由异丙苯制取该单体的化学反应方程式:
_________________ ____________________________________________________________。
____________________________________________________________。
(4)耐热型ABS树脂由丙烯腈(CH2=CHCN)、1,3-丁二烯和α-甲基苯乙烯1∶1∶1共聚生成,写出该树脂的结构简式______________________________。
一种烃的碳架呈三棱柱体(如图所示)
(1)写出该烃的分子式___ _______。
_______。
(2)该烃的一氯取代物有__________种。
(3)该烃的二氯取代物有__________种。
(4)该烃的同分异构体有多种,其中1种不能使酸性高锰酸钾溶液或Br2-CCl4溶液褪色,但在一定条件下能跟溴(或H2)发生取代(或加成)反应,这种同分异构体的结构简式是
____________________。
写出下列反应的化学方程式,注明反应类型:
(1)苯与浓硝酸、浓硫酸的混合物反应(60℃):___________________________________;
(2)甲苯制备 三硝基甲苯:_____________________________________________________;
三硝基甲苯:_____________________________________________________;
(3)乙烯与苯反应:__________________ ______________________________________;
______________________________________;
(4)丙烯与水反应生成醇(主要反应):__________________________________________;
反应类型依次是:____________________________________________________________。
(每空2分,共8分。)
1,4-环己二醇可通过下列路线合成(某些反应的反应物和反应条件未列出):
(1)写出反应④、⑦的化学方程式:
④______________________________________________________________;
⑦______________________________________________________________。
(2)上述七个反应中属于取代反应的有____________(填反应序号)。
(3)反应⑤中可能产生一定量的副产物,其可能的结构简式为。