科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8 kJ·mol-1、-283.0 kJ·mol-1和-726.5 kJ·mol-1。请回答下列问题:
(1)用太阳能分解10mol液态水消耗的能量是_____________kJ;
(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为________________________;
(3)用甲醇与氧气在碱性条件下形成燃料电池的负极电极离子方程式为_________________
(4)在容积为2 L的密闭容器中,由CO2和H2合成甲醇(CO2+3H2  CH3OH + H2O)
CH3OH + H2O)
在其他条件不变得情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃);下列说法正确的是______(填序号)
①温度为T1时,从反应开始到平衡,生成甲醇的平均速率为v(CH3OH) =nA/tA mol·L-1·min-1
②该反应在T1时的平衡常数比T2时的小
③该反应为放热反应
④处于A点的反应体系从T1变到T2,达到平衡时n(H2)/n(CH3OH)增大
(5)在T1温度时,将1mol CO2和3mol H2充入一密闭恒容器中,充分反应达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为_________________________。
(共15分)利用芳香烃X和烯烃Y可以合成紫外线吸收剂BAD。已知:G不能发生银镜反应,B遇FeCl3溶液显紫色,C到D的过程为引入羧基(—COOH)的反应。其中BAD结构简式为: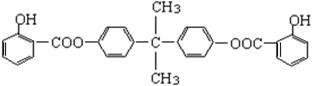
BAD的合成路线如下: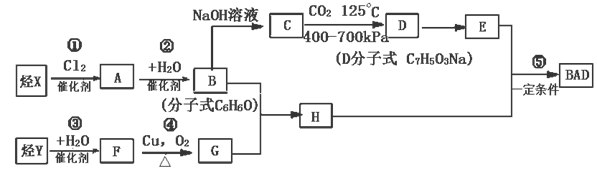
试回答下列问题:
(1)写出结构简式:Y ,D 。
(2)上述属于取代反应的有 (填数字序号)。
(3)1molBAD最多可与含 molNaOH的溶液完全反应。
(4)写出方程式
反应④ 。
B+E 。
(5)E有多种同分异构体,判断符合下列要求的同分异构体数目为 种。
①能发生银镜反应
②遇FeCl3溶液显紫色
③核磁共振氢谱图中有四个吸收峰
(共14分)SO2的含量是空气质量日报中一项重要检测指标,请结合所学知识回答下列问题。
(1)工业制硫酸过程中,SO2催化氧化的原理为:2SO2(g)+O2(g) 2SO3(g) 。T℃时,向某密闭容器中充入一定SO2(g)和O2(g),发生上述反应,测得SO2(g)的平衡转化率(a)与体系总压强(p)的关系如图所示。
2SO3(g) 。T℃时,向某密闭容器中充入一定SO2(g)和O2(g),发生上述反应,测得SO2(g)的平衡转化率(a)与体系总压强(p)的关系如图所示。
①a、b两点对应的平衡常数K(a) K(b)(填“>”、“<”或“=”,下同),SO2浓度c(a) c(b)。
②c点时,反应速率v(正) v(逆)。
(2)电化学法处理SO2。
硫酸工业尾气中的SO2经分离后,可用于制备硫酸,同时获得电能,装置如下图所示(电极均为惰性材料):
①M极发生的电极反应式为 。
②若使该装置的电流强度达到2.0A,理论上每分钟应向负极通入标准状况下气体的体积为 L(已知:1个e-所带电量为1.6×10-19C)。
(3)溶液法处理SO2。已知常温下H2SO3和H2CO3的电离常数如下表所示:
常温下,将SO2缓慢通入100mL 0.2mol•L-1的Na2CO3溶液中,当通入448mLSO2时(已折算为标准状况下的体积,下同),发生的离子方程式为 ;当通入896mLSO2时,所得溶液呈弱酸性,溶液中各离子浓度由大到小的顺序为 。
(共14分)氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业。CuCl难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如下:
回答下列问题:
(1)步骤①中得到的氧化产物是_________,溶解温度应控制在60~ 70℃,原因是________ 。
(2)写出步骤③中主要反应的离子方程式___________。若向亚硫酸氢铵溶液中加入过量氢氧化钠溶液,反应的离子方程式为 。
(3)步骤⑤包括用pH=2的酸洗、水洗两步操作,酸洗采用的酸是_________(写名称)。
(4)上述工艺中,步骤⑥不能省略,理由是________ _。
(5)准确称取所制备的氯化亚铜样品mg,将其置于过量的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,用amol/L的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液bmL,反应中Cr2O72-被还原为Cr3+,样品中CuCl的质量分数为__________。
(共12分)氯元素是生产生活中常见的非金属元素。
(1)将Cl2通入NaOH溶液中得到以NaClO为有效成分的漂白液,写出该反应的离子方程式 ;不直接用Cl2作漂白剂的原因是 (写出两条)。
(2)使用Cl2为自来水消毒时,会与水中的有机物生成对人体有害的有机氯化物。下列物质中可以替代Cl2为自来水杀菌消毒的是 (填字母序号)。
a.臭氧b.NH3 c.明矾 d.ClO2
(3)生物质混煤燃烧是当今能源燃烧利用的最佳方式之一,但生物质中氯含量较多,燃烧过程中会形成金属氯化物(如NaCl)和Cl2等物质,对金属炉壁造成腐蚀。
①NaCl和Cl2中化学键的类型分别是 和 。
②燃煤过程中生成的SO2会与NaCl等物质发生反应,生成硫酸盐和Cl2。若生成Cl2 22.4 L(标况)时转移电子数为4×6.02×1023,该反应的化学方程式是 。
③已知:2H2O2(l)=2H2O(l)+O2(g)ΔH1 = -196.46 kJ·mol-1
H2(g)+1/2O2(g)= H2O(l)ΔH2 = -285.84 kJ·mol-1
Cl2(g)+H2(g)=2HCl(g)ΔH3 = -184.60 kJ·mol-1
在催化剂作用下,用H2O2(l)可除去上述燃烧过程中产生的Cl2。依据上述已知反应,写出该反应的热化学方程式: 。
B:【化学—选修5有机化学基础】芳香族化合物A常用来合成药物B及医药中间体G,其流程如图: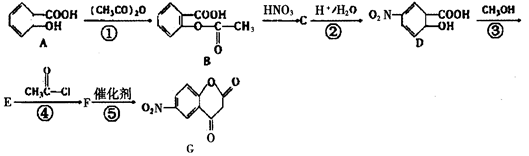
已知: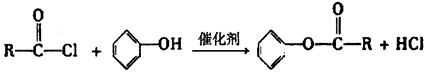
(1)D中除硝基外还含有的官能团的名称__________。D生成E的反应类型是________。
(2)鉴别A和E可用的试剂是__________________。
a.氢氧化钠溶液 b.氯化铁溶液
c.碳酸氢钠溶液 d.浓溴水
(3)反应①、③的作用____________________。
(4)写出反应⑤的化学方程式___________________。
写出F与过量NaOH共热时反应的化学方程式_________________。
(5)B有多种同分异构体,写出符合下列条件的一种物质的结构简式
①只有一种官能团
②能发生银镜反应
③苯环上的一氯取代物只有二种
④核磁共振氢谱共有四组峰,峰面积之比为3 :2 :2 :1