B:【化学—选修5有机化学基础】芳香族化合物A常用来合成药物B及医药中间体G,其流程如图:
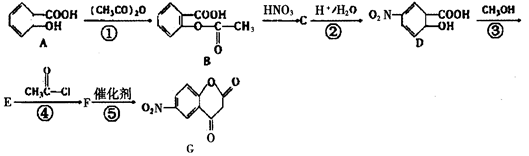
已知: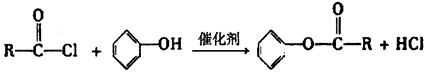
(1)D中除硝基外还含有的官能团的名称__________。D生成E的反应类型是________。
(2)鉴别A和E可用的试剂是__________________。
a.氢氧化钠溶液 b.氯化铁溶液
c.碳酸氢钠溶液 d.浓溴水
(3)反应①、③的作用____________________。
(4)写出反应⑤的化学方程式___________________。
写出F与过量NaOH共热时反应的化学方程式_________________。
(5)B有多种同分异构体,写出符合下列条件的一种物质的结构简式
①只有一种官能团
②能发生银镜反应
③苯环上的一氯取代物只有二种
④核磁共振氢谱共有四组峰,峰面积之比为3 :2 :2 :1
某火力发电厂以煤为燃料,充分燃烧后将热能转化为电能,其排出的废气中含有CO2、SO2、水蒸气等。为了检验该发电厂排出的废气中的成分,用如图所示的装置进行实验: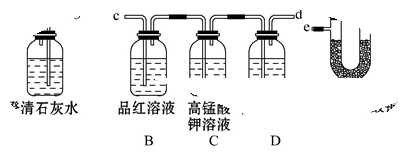
(1)仪器连接的顺序为(填导管接口字母) 。
(2)根据 现象能证明有SO2存在。
(3)根据 中无明显变化和装置A中 现象证明有CO2存在。
(4)把装置E放置在最后,能否证明该废气中含有水蒸气? ,理由是 。
(5)装置B的作用是 ,装置D的作用是 。
(6)将SO2通入氯水中溶液颜色变浅原因是___________________。
有A~I九种常见物质,它们的转化关系(反应条件未注明)如下图所示。已知:B、C、F为单质,常温常压下,B为固态,C、F为气态;化合物中仅A、E为气态;常温下,D为淡黄色粉末,H的焰色反应为黄色。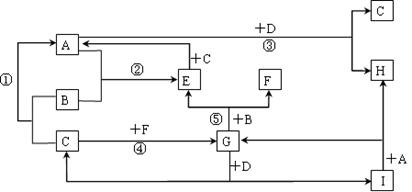
(1)A的电子式_________________; F的分子式___________________。
(2)写出G与D反应的化学方程式_________________________________。
(3)向100 mL I溶液中通入A,充分反应后,在减压和较低温度下,小心地将溶液蒸干,得到白色固体M。通入A的体积V(标准状况下) 与M的质量W的关系如图所示: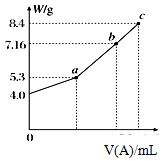
①a点时M的组成成分为______________。
② 若要使b点生成的盐的质量变为8.4 g,则应继续向溶液中通入二氧化碳________ mL (标准状况下).
下列有关实验的叙述,正确的是 (填序号)
| A.分液时,分液漏斗下层液体从下口放出,上层液体从上端口倒出 |
| B.氢气还原氧化铜实验中,先加热氧化铜后通氢气 |
| C.蒸馏石油时,加热一段时间后发现未加碎瓷片,立刻拔开橡皮塞并投入碎瓷片 |
| D.实验室做钠的实验时,余下的钠屑投入到原试剂瓶中 |
E.浓硫酸不小心沾到皮肤上,立刻用稀NaOH溶液洗涤
F.不慎将苯酚沾到皮肤上,立即用酒精清洗;
G.配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加入浓硝酸中,并不断搅拌;
H.配制银氨溶液时,将稀氨水慢慢滴加到硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止
I.用浓盐酸清洗做过高锰酸钾分解实验的试管
J.存放氯化亚铁溶液的试剂瓶则加些铁粉和稀盐酸
K.在实验室中常用加热NH4Cl固体的方法来制取氨气。
研究证明:使用氯气作自来水消毒剂,氯气会与水中有机物反应,生成如CHCl3等物质,这些物质可能是潜在的致癌致畸物质,目前人们已研发多种饮用水的新型消毒剂。亚氯酸钠(NaClO2)常用于水的消毒和砂糖、油脂的漂白与杀菌。以下是用过氧化氢法生产亚氯酸钠的工艺流程图:
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O。
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下较安全;
(1)在发生器中鼓入空气的作用可能是_________________________________。吸收塔内发生反应的化学方程式为_____________________。该工艺流程中的NaClO3、ClO2、NaClO2都是强氧化剂,它们都能和浓盐酸反应制取Cl2。若用二氧化氯和浓盐酸制取Cl2,当生成0.5 mol Cl2时,反应中转移电子的个数是________。
(2)吸收塔的温度不能超过20℃,其目的是_____________。吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性物质中除H2O2外,还可以选择的还原剂是_____(选填序号)。
a.Na2O2 b.Na2S c.FeCl2
(3)从滤液中得到的NaClO2·3H2O晶体的操作依次是__________(填写序号)。
a.蒸发 b.灼烧 c.过滤 d.冷却结晶
(4)印染工业常用亚氯酸钠(NaClO2)漂白织物。亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体,25℃时,各组分含量随pH变化情况如图所示(Cl-没有画出)。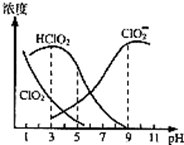
回答下列问题:
①该温度下NaClO2溶液中c(Na+)__________c(ClO2-)(填“>”“=”或“<”),原因是________________________________(用一个离子方程式表示);
②使用该漂白剂的最佳pH为_____;
| A.3.0 | B.4.0-4.5 | C.6.5-7.0 | D.9.0 |
③根据图中数据,当pH=8时,往NaClO2溶液中滴入稀盐酸,溶液中主要反应的离子方程式为_______。
请结合化学反应原理回答下列问题:
(1)硫酸的产量通常用来衡量一个国家的化学工业发展水平,硫酸工业生产中涉及反应之一为:
2SO2(g)+O2(g) 2SO3(g),SO2的平衡转化率与温度、压强的关系如右图所示。
2SO3(g),SO2的平衡转化率与温度、压强的关系如右图所示。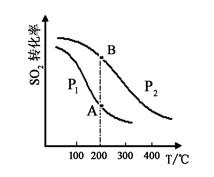
①压强:P1 P2(填“>”、“=”或“<”)。
②200℃下,将一定量的SO2和O2充入体积不变的密闭容器中,经10min后测得容器中各物质的物质的量浓度如下表所示:
| 气体 |
SO2 |
O2 |
SO3 |
| 浓度(mol/L) |
0.4 |
1.2 |
1.6 |
能说明该反应达到化学平衡状态的是 。
a.反应速率υ(SO2)=υ(SO3)
b.体系的压强保持不变
c.混合气体的密度保持不变
d.SO2和O2的体积比保持不变
计算上述反应在0~10min内,υ(SO2)= 。
(2)SO2与氢氧化钠溶液反应可以生成亚硫酸氢钠,已知25℃时,NaHSO3的水解平衡常数=1.0×10-12mol/L,则该温度下H2SO3 HSO3-+H+的电离常数Ka=____mol/L,若向H2SO3溶液中加入少量的I2,则溶液中
HSO3-+H+的电离常数Ka=____mol/L,若向H2SO3溶液中加入少量的I2,则溶液中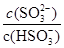 将________(填“增大”、“减小”或“不变”)。
将________(填“增大”、“减小”或“不变”)。
(3)工业制取硫酸还可以利用电化学原理:
①工业生产中用SO2为原料制取硫酸可以利用原电池原理,用SO2、O2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触。请写出该电池的正极电极反应式_____________。
②用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸。电解原理示意图如下图所示。请写出开始时阳极反应的电极反应式_________。