有A~I九种常见物质,它们的转化关系(反应条件未注明)如下图所示。已知:B、C、F为单质,常温常压下,B为固态,C、F为气态;化合物中仅A、E为气态;常温下,D为淡黄色粉末,H的焰色反应为黄色。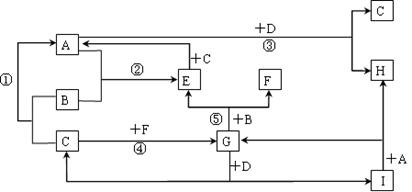
(1)A的电子式_________________; F的分子式___________________。
(2)写出G与D反应的化学方程式_________________________________。
(3)向100 mL I溶液中通入A,充分反应后,在减压和较低温度下,小心地将溶液蒸干,得到白色固体M。通入A的体积V(标准状况下) 与M的质量W的关系如图所示: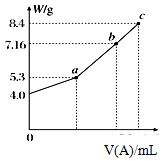
①a点时M的组成成分为______________。
② 若要使b点生成的盐的质量变为8.4 g,则应继续向溶液中通入二氧化碳________ mL (标准状况下).
把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的浊液中逐滴加入1mol/L HCl溶液,加入HCl溶液的体积与生成沉淀的质量关系如图,
试回答:
(1)A点的沉淀物的化学式为 ,理由是 。
(2)B点沉淀物的化学式为_____________,A到B的离子方程式 。
(3)原混合物中MgCl2的质量是 ,AlCl3的质量是 ,NaOH的质量是 。
(4)Q点溶液的体积为 mL。
在浓硝酸中放入铜片发生反应:
(1)待反应停止后,若铜有剩余,再加入少量25%的稀硫酸,这时铜片上又有气泡产生,原因是 (用离子方程式表示)
(2)若将12.8g铜跟一定量的浓硝酸反应,铜耗完时,共产生气体5.6L(标况)。则所消耗硝酸的物质的量是 mol
(3)将收集上述气体的容器倒扣在盛有水的水槽中,并向其中缓慢通入O2,使其充分反应,若要使水恰好充满容器,理论上需要参加反应的O2的物质的量是 mol
有下列物质:①H2SO4;②金属铜;③Al2O3;④漂白粉;⑤蔗糖;⑥醋酸;⑦NO;⑧SiO2。
(1)请用序号填写空白:以上物质中属于混合物的是____________;能导电的是____________;属于弱电解质的是____________;能引起光化学烟雾的是____________;属于两性氧化物的是 ;可用作光导纤维原料的是 。
(2)写出H2SO4在水中的电离方程式: 。
(3)写出Al2O3溶于NaOH溶液的离子方程式:____________。
工业上用铝土矿(主要成分SiO2、Al2O3、Fe3O4)提取氧化铝作冶炼铝的原料,提取的操作过程如下图所示:
(1)不溶物为___________(写化学式,下同),滤液甲中的溶质为______________________;
(2)滤液甲中含铝元素的溶质与过量NaOH溶液反应进入滤液乙,发生此反应的反应物的物质的量之比为_____________。若使用氨水能否达到上述目的__________(填“能”或“否”)。
(3)若向滤液甲中加入碘化钾溶液,相关的离子反应方程式为______________________,从该溶液中获得碘单质需要加入____________(填试剂名称),振荡、静置,再经______________(填操作名称),蒸馏后即得到碘单质。
(4)③步骤中通入二氧化碳是过量的,写出此步发生的离子反应方程式:_____________________;
(5)若将铝土矿用过量氢氧化钠溶液溶解,过滤后向滤液中通入过量CO2,再经过滤、加热得到的物质是______________________。
(6)②步骤得到的沉淀为灰绿色,沉淀变为红褐色需要较长时间,欲快速得到红褐色沉淀,可以向此沉淀中加入过量的_________(填字母)
| A.过氧化钠 | B.氯水 | C.稀硝酸 | D.酸性高锰酸钾溶液 |
为确定SO2、CO2、Cl2的混合气体的各种成分,小龙同学做了如下探究。
(1)三种气体都具有的性质是___________(填字母);
A.漂白性和氧化性 B.水溶液显酸性 C.能与碳酸钠溶液反应 D.能与非金属单质反应
(2)通过观察颜色,可以确定混合气体中含有_________,为了检验另两种气体,可以将混合气体通过下列试剂中的_____________________(填字母)洗去该气体;
A.氢氧化钠溶液 B.饱和食盐水 C.硫化氢溶液 D.四氯化碳
(3)确定另外两种气体的成分时,需要依次通过A、B、C、D四个洗气瓶:
A.品红溶液 B.酸性高锰酸钾溶液 C.品红溶液 D.澄清石灰水
①能说明混合气体中含有CO2的实验现象是_______________________________;
②B中溶液紫红色褪去产生Mn2+和SO42-写出此反应的离子反应方程式_______________________。