下表为元素周期表的一部分,a、b、c…为部分元素。回答下列问题:
| a |
|
|
|||||||||||||||
| |
|
|
|
f |
y |
h |
i |
|
|||||||||
| |
b |
|
e |
|
|
|
j |
|
|||||||||
| c |
|
|
|
|
|
|
d |
|
d |
|
g |
|
l |
|
|
|
|
| |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1)请写出上述元素d3+的核外电子排布式 ;
(2)请写出e元素的原子价电子轨道表示式 ;
(3)ya3分子的电子式是 ,其分子的空间构型是 ,
(4)b、e两种元素中,金属性较强的是 ;第一电离能大的是_______.(填元素符号)
(5)h的i形成hi2分子杂化类型是________ fh3-的空间构型分别为_______________
a、b、c、d、e是含有一种相同元素的五种物质,可发生如下转化: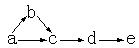
其中: a是单质;b是气体;c、d是氧化物;e是最高价氧化物对应的水化物。
(1)如果a是一种黄色粉末固体,试推断这五种物质(用名称表示):
a; e。
写出c→d的化学方程式。
(2)如果a是一种常见气体,试推断这五种物质(用化学式表示):
a; d。
写出b→c的化学方程式 。
。
根据提供条件推断元素,并按要求填空:
(1)原子核外有3个电子层,其价电子数为7,最高价氧化物化学式,最高价氧化物对应水化物化学式,其单质与NaOH反应的化学方程式为。
(2)原子最外层电子数是电子层数 三倍的非金属元素,与氢元素组成的化合物有两种,其化学式分别为、,其单质也有两种,化学式分别为、。
三倍的非金属元素,与氢元素组成的化合物有两种,其化学式分别为、,其单质也有两种,化学式分别为、。
(3)原子序数依次递增的四种元素,它们氢化物的质子数与电子数都与Ne相同,这些氢化物的化学式分别为、、、。
在周期表主族元素中,甲元素与乙、丙、丁三元 素上下或左右紧密相邻。甲、乙两元素的原子序数之和等于丙元素的原子序数,这四种元素原子的最外层电子数之和为20个。据此可以判断:
素上下或左右紧密相邻。甲、乙两元素的原子序数之和等于丙元素的原子序数,这四种元素原子的最外层电子数之和为20个。据此可以判断:
(1)甲为元素,丙为元素;
(2)元素乙和丁所形成化合物的分子式为或。
有下列四种微粒:① 、②
、②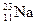 、③
、③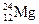 、④
、④ 。用①、②、③、④回答:
。用①、②、③、④回答:
(1)按原子半径由大到小顺序排列的是,
(2) 微粒中质子数小于中子数的是,
微粒中质子数小于中子数的是,
(3)在化合物中呈现的化合价的数值最高的是,
(4)能形成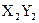 型化合物的是。
型化合物的是。
某元素位于第三周期,第ⅦA 族,它是元素,与K相邻的同族元素的原子序数是和。