汽车尾气是城市空气的主要污染物,如何减少汽车尾气(CO、NOx等)的污染是重要的科学研究课题。
(1) 已知:N2(g) + O2(g) 2NO(g) ΔH1
2NO(g) ΔH1
N2(g) + 3H2(g) 2NH3(g) ΔH2
2NH3(g) ΔH2
2H2(g) + O2(g) 2H2O(g) ΔH3
2H2O(g) ΔH3
则4NO(g) + 4NH3(g) + O2(g) 4N2(g) + 6H2O(g) ΔH =____________(用ΔH1、ΔH2、ΔH3表达)
4N2(g) + 6H2O(g) ΔH =____________(用ΔH1、ΔH2、ΔH3表达)
(2) 在密闭容器中,一定条件下,进行如下反应:2NO(g)+2CO(g) N2(g)+2CO2(g),下列说法不能说明该反应达到平衡的是__________ (填字母)
N2(g)+2CO2(g),下列说法不能说明该反应达到平衡的是__________ (填字母)
| A.NO的生成速率与NO的消耗速率相等 |
| B.v(CO)=v(CO2) |
| C.体系的压强保持不变 |
| D.各物质的浓度保持不变 |
(3) 可用活性炭还原法处理氮氧化物。有关反应的化学方程式为:
C(s) + 2NO(g) N2(g) + CO2(g) ΔH >0
N2(g) + CO2(g) ΔH >0
某研究小组向密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
浓度/mol·L-1
时间/min |
NO |
N2 |
CO2 |
||
| 0 |
0.100 |
0 |
0 |
||
| 10 |
0.058 |
0.021 |
0.021 |
||
| 20 |
0.040 |
0.030 |
0.030 |
||
| 30 |
0.040 |
0.030 |
0.030 |
||
| 40 |
0.032 |
0.034 |
0.017 |
① 写出该反应的平衡常数表达式:K= 。
②30 min后,改变某一条件,平衡发生了移动,则改变的条件是 ;若升高温度,NO浓度将 (填“增大”、“不变”或“减小”)。
中国食疗网发布“反式脂肪酸预警报告”,报告称:脂肪酸分为顺式脂肪酸、反式脂肪酸两种,摄入过多的反式脂肪酸,容易堵塞血管而导致心脑血管疾病。两种脂肪酸的结构如图所示。试回答下列问题:
(1)脂肪酸中所含官能团的名称是_______________________________。
(2)上述“A”、“B”结构能表示“反式脂肪酸”的是(填“A”或“B”)
(3)上述顺(反)式脂肪酸都能与H2在一定条件下发生氢化反应,其产物关系为 。
。
| A.同分异构体 | B.同系物 | C.同一种物质 | D.对映异构体 |
(4)CH2 =CHCH2OH发生加成聚合反应后,所得产物的结构简式为______________
=CHCH2OH发生加成聚合反应后,所得产物的结构简式为______________
现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子 Na+、Al3+、Mg2+、Ba2+、Fe3+和五种阴离子Cl-、OH-、NO3-、CO32-、X中的一种。
(1)某同学通过分析,认为无需 检验就可判断其中必有的两种物质是和(填化学式)。
检验就可判断其中必有的两种物质是和(填化学式)。
(2)为了确定X,现将(1)中的两种物质记为A和B,含X的物质记C,当C与B的溶液混合时,产生红褐色沉淀和无色无味气体;当C与A的溶液混合时也产生红褐色沉淀,向该沉淀中滴人稀硝酸沉淀部分溶解,最后留有白色沉淀不再溶解。则X为。
A.SO32-B.SO42-C.CH3COO- D.SiO32-
(3)B的水溶液显性,原因为。(用离子方程式表示)
(4)将0.02 molA与0.0 1molC同时溶解在足量的蒸馏水中,充分反应后,最终所得沉淀的物质的量为 (保留一位小数)
(保留一位小数)
(5)将Cu投人到装有D溶液的试管中,Cu不溶解;再 滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现。则物质D一定含有上述离子中的
滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现。则物质D一定含有上述离子中的 (填相应的离子符号)。有关反应的离
(填相应的离子符号)。有关反应的离 子方程式为:。
子方程式为:。
(6)利用上述已经确定的物质,可以检验出D、E中的阳离子。请简述实验操作步骤、现象及结论。
(18)工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g)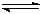 CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。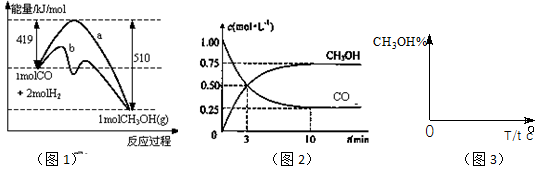
请回答下列问题:
(1)在“图1”中,曲线(填:a或b)表示使用了催化剂;该反应属于(填:吸热、放热)反应。
(2)下列说法正确的是
A.起始充入的CO为2mol
B.增加CO浓度,CO的转化率增大
C.容器中压强恒定时,反应已达平衡状态
D.保持温度和密闭容器容积不 变,再充入1molCO和2molH2,再次达到平衡时
变,再充入1molCO和2molH2,再次达到平衡时
n(CH3OH)/n(CO)会减小
(3)从 反应开始到建成平衡, v(H2)=________;已知:在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,这个常数就是该反应的化学平衡常数,那么在该温度下CO(g)+2H2(g)
反应开始到建成平衡, v(H2)=________;已知:在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,这个常数就是该反应的化学平衡常数,那么在该温度下CO(g)+2H2(g) 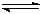 CH3OH(g)的化学平衡常数为_______________。若保持其它条件不变,将反应体系升温,则该反应化学平衡常数____
CH3OH(g)的化学平衡常数为_______________。若保持其它条件不变,将反应体系升温,则该反应化学平衡常数____ (填“增大”、“减小”或“不变”)。
(填“增大”、“减小”或“不变”)。
(4)请在“图3”中画出平衡时甲醇百分含量(纵坐标)随温度(横坐标)变化的曲线,要求画压强不同的2条曲线(在曲线上标出P1、P2,且P1<P2)。
(5) 有一类甲醇质子交换膜燃料电池,需将甲醇蒸气转化为氢气,两种反应原理是
A、CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0kJ/mol
B、CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ΔH=-192.9kJ/mol
又知H2O(l)= H2O(g) ΔH=+44 kJ/mol,请写出32g的CH3OH(g)完全燃烧生成液态水的热化学方程式。
有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大。A原子核内无中子;A和E、D和F分别同主族,且B与D 最外层电子数之比为2:3。试回答下列问题:
(1)A元素的名称是,E元素在周期表中的位置是;
(2)C、D、F的气 态氢化物稳定性由强到弱的顺序是(填化学式);
态氢化物稳定性由强到弱的顺序是(填化学式);
(3)E单质在足量D单质中燃烧生成的化合物的电子式是;
(4)化合物X、Y均由A、D、E、F四种元素组成。
①X、Y均属于晶体;
②X与Y的水溶液相混合发生反应的离子方程式为;
(5)向化合物E2F的水溶液中滴入双氧水和稀硫酸,加热,有单质生成。其离子反应方程式为: ;
;
(6)若由A、 C组成的简单氢化物燃烧生成无污染物,燃烧热为aKJ/mol,请写出表示该简单氢化物燃烧热的热化学方程式。
图中X、Y、Z为单质,其他为化合物,它们之间存在如下转化关系(部分产物已略去)。其中,A俗称磁性氧化铁;E是不溶于水的酸性氧化物,能与氢氟酸 反应。回答下列问题:
反应。回答下列问题:
(1)组成单质Y的元素在周期表中的位置是;M中存在的化学键类型为; R的化学式是。
R的化学式是。
(2)一定条件下,Z与H2反应生成ZH4,ZH4的电子式为。
(3)写出A和D的稀溶液反应生成G的离子方程式:。
(4)向含4mol D的稀溶液中,逐渐加入X粉末至过量。假设生成的气体只有一种,则n(X2+)的最大值为。