(18)工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g)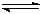 CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。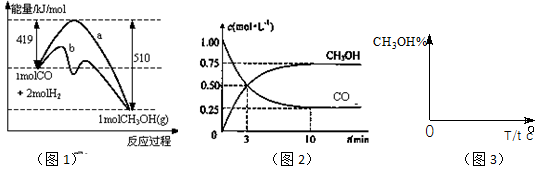
请回答下列问题:
(1)在“图1”中,曲线 (填:a或b)表示使用了催化剂;该反应属于 (填:吸热、放热)反应。
(2)下列说法正确的是
A.起始充入的CO为2mol
B.增加CO浓度,CO的转化率增大
C.容器中压强恒定时,反应已达平衡状态
D.保持温度和密闭容器容积不 变,再充入1molCO和2molH2,再次达到平衡时
变,再充入1molCO和2molH2,再次达到平衡时
n(CH3OH)/n(CO)会减小
(3)从 反应开始到建成平衡, v(H2)=________;已知:在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,这个常数就是该反应的化学平衡常数,那么在该温度下CO(g)+2H2(g)
反应开始到建成平衡, v(H2)=________;已知:在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,这个常数就是该反应的化学平衡常数,那么在该温度下CO(g)+2H2(g) 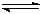 CH3OH(g)的化学平衡常数为_______________。若保持其它条件不变,将反应体系升温,则该反应化学平衡常数____
CH3OH(g)的化学平衡常数为_______________。若保持其它条件不变,将反应体系升温,则该反应化学平衡常数____ (填“增大”、“减小”或“不变”)。
(填“增大”、“减小”或“不变”)。
(4)请在“图3”中画出平衡时甲醇百分含量(纵坐标)随温度(横坐标)变化的曲线,要求画压强不同的2条曲线(在曲线上标出P1、P2,且P1<P2)。
(5) 有一类甲醇质子交换膜燃料电池,需将甲醇蒸气转化为氢气,两种反应原理是
A、CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0kJ/mol
B、CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ΔH=-192.9kJ/mol
又知H2O(l)= H2O(g) ΔH=+44 kJ/mol,请写出32g的CH3OH(g)完全燃烧生成液态水的热化学方程式 。
(1)写出砷的元素符号 ,原子中所有电子占有__________个轨道,核外共有_________个不同运动状态的电子。
(2)写出Ni的元素名称 ,该元素在周期表的位置为第 周期,第 族。
(3)第四周期基态原子中未成对电子数最多的元素是 ,该元素基态原子的价电子轨道表示式为 。
(4)第三电子层上有__________个能级,作为内层最多可容纳_________个电子,作为最外层时,最多可含有__________个未成对电子。
如图是可用于测量阿伏加德罗常数的装置示意图,其中A是纯铜片、B是石墨,插在100mLCuSO4稀溶液中,铜片、石墨与引出导线相连,引出端分别为X、Y。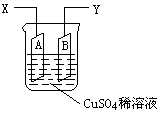
(1)当以IA的电流电解6min后,测得铜片A质量减少2.56g,则图装置中的X端应与直流电的 极相连。
(2)电解后将电源反接,2IA的电流电解6min后,假设溶液体积不变,测得溶液中CuSO4物质的量浓度为0.1mol/L,则原溶液中CuSO4物质的量浓度 mol/L。溶液中H+的物质的量浓度为 mol/L。
(3)列式计算实验测得的阿伏加德罗常数NA(用I表示) mol-1。(已知电子电量e=1.60×10–19C)
下图为Zn-Cu原电池的示意图,请回答:
(1)锌片为原电池的 (填“正”或“负”)极,该极的电极反应式是 。该反应属于 (填“氧化”或“还原”)反应。
(2) (填“电子”或“电流”)从锌片通过导线流向铜片,溶液中 的从 (填“锌片”或“铜片”)获得电子。
的从 (填“锌片”或“铜片”)获得电子。
(3)原电池工作一段时间后, 溶液的浓度(填“增大”或“减小”,下同),烧杯中溶液的质量 。
溶液的浓度(填“增大”或“减小”,下同),烧杯中溶液的质量 。
(4)若锌片质量减轻6.5g,则另一极放出气体的体积为 L(标准状况)。
一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。从废料中回收氧化钴(CoO)的工艺流程如下:
(1)过程I中采用NaOH溶液溶出废料中的Al,反应的离子方程式为 。
(2)过程Ⅱ中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴。则浸出钴的化学反应方程式为(产物中无沉淀且只有一种酸根) 。在实验室模拟工业生产时,也可用盐酸浸出钴,但实际工业生产中不用盐酸,请从反应原理分析不用盐酸浸出钴的主要原因______________ 。
(3)过程Ⅲ得到锂铝渣的主要成分是LiF和Al(OH)3,碳酸钠溶液在产生Al(OH)3时起重要作用,请写出该反应的离子方程式____________________。
(4)碳酸钠溶液在过程Ⅲ和Ⅳ中所起作用有所不同,请写出在过程IV中起的作用是_____________。
(5)在Na2CO3溶液中存在多种粒子,下列各粒子浓度关系正确的是____________(填序号)。
| A.c(Na+) = 2c(CO32-) |
| B.c(Na+) > c(CO32-) > c(HCO3-) |
| C.c(OH-) > c(HCO3-) > c(H+) |
| D.c(OH-) - c(H+) ="=" c(HCO3-) + 2c(H2CO3) |
(6)CoO溶于盐酸可得粉红色的CoCl2溶液。CoCl2含结晶水数目不同而呈现不同颜色,利用蓝色的无水CoCl2吸水变色这一性质可制成变色水泥和显隐墨水。下图是粉红色的CoCl2·6H2O晶体受热分解时,剩余固体质量随温度变化的曲线,A物质的化学式是____________。
现有下列短周期元素性质的有关数据: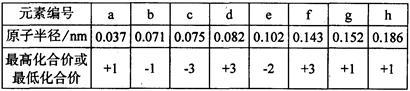
(1)根据元素周期律确定a至h 8种元素在周期表中的位置,将它们的元素编号填入下表相应的空格内。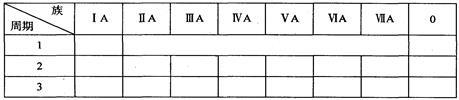
(2)上述元素形成的氢化物中,分子间存在氢键的有(填氢化物的化学式)_______________。
(3)氢化铝锂(LiAlH4)是一种易燃易爆具有极强还原性的物质,它在有机合成上应用广泛。在125℃时氢化铝锂分解为氢气、金属铝及氢化锂(LiH)。
①氢化铝锂易水解,最初得三种产物,请写出其水解反应方程式________________。
②与氢化铝锂性质相似但较为温和的还原剂由上述a、d、h三种元素组成,请写出这种还原剂的电子式 。写出该物质受热分解的反应方程式:______ _______。
(4)原子数相同,电子总数相同的分子或离子互称等电子体。在元素周期表中,与碳相邻的两种元素可形成具有石墨型晶体结构的“白石墨”,“白石墨”和石墨具有等电子体特征,写出“白石墨”的最小结构单元--六元环的结构式