有机物A由碳、氢、氧三种元素组成,可由葡萄糖发酵得到,也可从酸牛奶中提取,纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
| (1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍。 |
(1)有机物A的相对分子质量为 |
| (2)将此9.0gA在足量纯O2充分燃烧,并使其产物依次通过碱石灰、无水硫酸铜粉末、足量石灰水,发现碱石灰增重14.2g,硫酸铜粉末没有变蓝,石灰水中有10.0g白色沉淀生成;向增重的碱石灰中加入足量盐酸后,产生4.48L无色无味气体(标准状况)。 |
(2)9.0g有机物A完全燃烧时,经计算: 生成CO2共为 mol, 生成的H2O g, 有机物A的分子式 。 |
| (3)经红外光谱测定,证实其中含有-OH键,-COOH基团,C-H键;其核磁共振氢谱有四组峰,面积比为1﹕3﹕1﹕1。 |
(3)A的结构简式 |
| (4)经红外光谱测定,A的一种同分异构体中,存在-OH键,还含有醛基,C-O键;其核磁共振氢谱有五组峰,面积比为1﹕2﹕1﹕1﹕1。 |
(4)A的同分异构体的结构简式 |
| (5)如果经红外光谱测定,A的一种同分异构体中,存在-OH键,还含有C=O,C-O键; 其核磁共振氢谱有两组峰,面积比为1﹕2。 |
(5)A的同分异构体的结构简式 |
联氨(N2H4)及其衍生物是一类重要的火箭燃料。N2H4与N2O4反应能放出大量的热。 (1)已知:2NO2(g)
(1)已知:2NO2(g) N2O4(g) △H=-57.20kJ·mol-1。一定温度下,在密闭容器中此反应达到平衡。
N2O4(g) △H=-57.20kJ·mol-1。一定温度下,在密闭容器中此反应达到平衡。 其他条件不变时,下列措施不能使NO2转化率提高的是()
其他条件不变时,下列措施不能使NO2转化率提高的是()
| A.扩大容器容积 | B.降低温度 | C.增加NO2的浓度 | D.降低N2O4浓度 |
 (2)25℃时,1.00gN2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14kJ的热量。则反应2N2H4(l)+N2O4(l)=3N2(g)+4H2O(l)的△H= kJ·mol-1
(2)25℃时,1.00gN2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14kJ的热量。则反应2N2H4(l)+N2O4(l)=3N2(g)+4H2O(l)的△H= kJ·mol-1 (3)17℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)="0.0300" mol·L-1、c(N2O4)="0.0120" mol·L-1。计算反应2NO2(g)
(3)17℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)="0.0300" mol·L-1、c(N2O4)="0.0120" mol·L-1。计算反应2NO2(g) N2O4(g)的平衡常数K= 。
N2O4(g)的平衡常数K= 。 (4)肼易溶于水,它是与氨类似的弱碱,用电离方程式表示肼的水溶液显碱性的原因 。
(4)肼易溶于水,它是与氨类似的弱碱,用电离方程式表示肼的水溶液显碱性的原因 。
(5)已知:在相同条件下N2H4•H2O的电离程度大于N2H5C1的水解程度.常温下,若将0.2mol/LN2H4•H2O溶液与0.1mol/LHCl溶液等体积混合,则溶液中N2H+5、Cl-、OH-、H+离子浓度由大到小的顺序为:_________________________________________________。
(10分) 图①-⑪分别代表有关反应中的一种物质,请填下以下空白。
(1)①、④的化学式分别是______、______。
用电子式表示②的形成过程为 。
(2)⑧与⑨反应的化学方程式是______ 。
检验③的存在的方法是 。
(3)Mg也可以与⑧的稀溶液反应生成⑥,写出反应的离子方程式
。
目前雾霾现象较严重,某些燃料的过度使用是原因之一,有人提出二甲醚是一种重要的清洁燃料。工业上可利用煤的气化产物合成二甲醚。请回答下列问题:
(1) 利用水煤气合成二甲醚的三步反应如下:
① 2H2(g)+CO(g) CH3OH(g); ΔH=-90.8kJ·mol-1
CH3OH(g); ΔH=-90.8kJ·mol-1
② 2CH3OH(g) CH3OCH3(g)+H2O(g); ΔH=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g); ΔH=-23.5kJ·mol-1
③ CO(g)+H2O(g) CO2(g)+H2(g); ΔH=-41.3kJ·mol-1
CO2(g)+H2(g); ΔH=-41.3kJ·mol-1
总反应:3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)的ΔH= ;
CH3OCH3(g)+CO2(g)的ΔH= ;
(2)工业上还可利用上述反应中的CO2和H2合成二甲醚反应如下:
6H2(g)+2CO2(g) CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
已知该反应平衡常数(K)与温度(T)的关系如图所示:
①该反应的平衡常数表达式为 。
②若升高温度,则平衡向 反应方向移动(填“正”或“逆”)
③一定温度下,在一个固定体积的密闭容器中进行该反应.下列能判断反应
达到化学平衡状态的是 (选填编号)。
a.c(H2)与c(H2O)的比值保持不变b.单位时间内有2molH2消耗时有t molH2O生成
c.容器中气体密度不再改变d.容器中气体压强不再改变
(3) 氢能源是理想的能源,是治理雾霾现象的途径之一。
①用丙烷和水为原料在电催化下制氢气,同时得到一种含有单三元环的环氧化合物A,该反应的化学方程式为 ; 该反应也可生成A的同分异构体——另一种环氧化合物B,B的核磁共振氢谱为下图中的 (填“a”或“b”)。
②已知叠氮酸(HN3)不稳定,同时也能与活泼金属反应,反应方程式为:
2HN3=3N2↑+H2↑
2HN3+Zn=Zn(N3)2+H2↑
0.2mol HN3与一定量Zn完全反应,在标准状况下生成6.72L气体,其中被金属锌还原HN3物质的
量为 。
硅藻土是由硅藻死亡后的遗骸沉积形成的,主要成分是 SiO2和有机质,并含有少量的Al2O3、Fe2O3、MgO 等杂质。精制硅藻土因为吸附性强、化学性质稳定等特点被广泛应用。下图是生产精制硅藻土并获得Al(OH)3的工艺流程。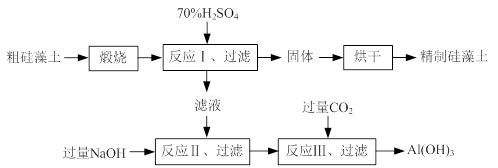
(1)粗硅藻土高温煅烧的目的是 。
(2)反应Ⅱ中加入过量氢氧化钠的作用是 。
(3)反应Ⅲ中生成Al(OH)3沉淀的离子方程式是 ;氢氧化铝常用作阻燃剂,其原因是 。
(3)实验室用酸碱滴定法测定硅藻土中硅含量的步骤如下:
步骤1:准确称取样品a g,加入适量KOH固体,在高温下充分灼烧,冷却,加水溶解。
步骤2:将所得溶液完全转移至塑料烧杯中,加入硝酸至强酸性,得硅酸浊液。
步骤3:向硅酸浊液中加入NH4F溶液、饱和KCl溶液,得K2SiF6沉淀,用塑料漏斗过滤并洗涤。
步骤4:将K2SiF6转移至另一烧杯中,加入一定量蒸馏水,采用70 ℃水浴加热使其充分水解(K2SiF6+3H2O=H2SiO3+4HF+2KF)。
步骤5:向上述水解液中加入数滴酚酞,趁热用浓度为c mol·L-1 NaOH的标准溶液滴定至终点,消耗NaOH标准溶液VmL。
①步骤1中如何判断固体反应完成?请设计实验说明 。
②实验中使用塑料烧杯和塑料漏斗的原因是 。
③步骤3中采用饱和KCl溶液洗涤沉淀,其目的是 。
④样品中SiO2的质量分数可用公式“ ×100%”进行计算。由此分析步骤5中滴定反应的离子方程式为 。
×100%”进行计算。由此分析步骤5中滴定反应的离子方程式为 。
过碳酸钠(xNa2CO3·yH2O2·zH2O)的组成可通过下列实验测定:①准确称取2.3840g样品,配制成100ml溶液A 。②准确量取25.00 ml溶液A,加入BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.788g。③准确量取25.00 ml溶液A,加入适量稀硫酸酸化后,用0.06400mol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液25.00 ml。H2O2与KMnO4反应的离子方程式如下:
2MnO4-+5H2O2+6H+=4Mn2++8H2O+5O2↑
(1)滴定操作时高锰酸钾溶液应装在 (酸式或碱式)滴定管;滴定终点的现象是
(2)向上述滴定后的溶液中,加入氢氧化钠溶液可得白色沉淀,后立即被空气中的氧气氧化成棕色的 MnO(OH)2,其总反应的离子方程式为: 。
(3)通过计算确定过碳酸钠的组成(写出计算过程)。