联氨(N2H4)及其衍生物是一类重要的火箭燃料。N2H4与N2O4反应能放出大量的热。
 (1)已知:2NO2(g)
(1)已知:2NO2(g) N2O4(g) △H=-57.20kJ·mol-1。一定温度下,在密闭容器中此反应达到平衡。
N2O4(g) △H=-57.20kJ·mol-1。一定温度下,在密闭容器中此反应达到平衡。 其他条件不变时,下列措施不能使NO2转化率提高的是( )
其他条件不变时,下列措施不能使NO2转化率提高的是( )

| A.扩大容器容积 | B.降低温度 | C.增加NO2的浓度 | D.降低N2O4浓度 |
 (2)25℃时,1.00gN2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14kJ的热量。则反应2N2H4(l)+N2O4(l)=3N2(g)+4H2O(l)的△H= kJ·mol-1
(2)25℃时,1.00gN2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14kJ的热量。则反应2N2H4(l)+N2O4(l)=3N2(g)+4H2O(l)的△H= kJ·mol-1
 (3)17℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)="0.0300" mol·L-1、c(N2O4)="0.0120" mol·L-1。计算反应2NO2(g)
(3)17℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)="0.0300" mol·L-1、c(N2O4)="0.0120" mol·L-1。计算反应2NO2(g) N2O4(g)的平衡常数K= 。
N2O4(g)的平衡常数K= 。
 (4)肼易溶于水,它是与氨类似的弱碱,用电离方程式表示肼的水溶液显碱性的原因 。
(4)肼易溶于水,它是与氨类似的弱碱,用电离方程式表示肼的水溶液显碱性的原因 。
(5)已知:在相同条件下N2H4•H2O的电离程度大于N2H5C1的水解程度.常温下,若将0.2mol/L N2H4•H2O溶液与0.1mol/L HCl溶液等体积混合,则溶液中N2H+5、Cl-、OH-、H+离子浓度由大到小的顺序为:_________________________________________________。
10分)(1)某温度(t ℃)时,水得到KW=10-13,则该温度______25℃,(填“<”“>”或“=”),将此温度下pH=1的硫酸溶液aL与pH=12的氢氧化钠溶液bL混合。若所得混合液为中性,则a:b=;
(2)下列溶液,c(H+)由小到大的排列顺序是_________,pH由小到大排列顺序是________;(填序号)①0.1 mol/LHCl溶液②0.1 mol/LH2SO4溶液③0.1 mol/LNaOH溶液
④0.1 mol/LCH3COOH溶液
(3)对于Ag2S(s)  2Ag+(aq)+ S2-(aq),其Ksp=____________。
2Ag+(aq)+ S2-(aq),其Ksp=____________。
(共5分)如图转化关系中A—H为中学常见化合物,甲、乙、丙、丁为常见单质,其中甲、丁常温为气体。已知单质乙、化合物A为黄色(或淡黄色)固体。乙经过连续与甲反应后,再与水化合,是工业上制H的反应过程。B、F两种气体都能使澄清石灰水变浑浊。(部分反应物或产物略去)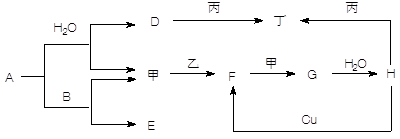
(1)写出下列反应的化学方程式:
A与B ____________________________________________________
Cu与H ___________________________________________________
F与甲____________________________________________________
(2)写出丙与D溶液反应的离子方程式 _______________________________________
(3)常温时H的浓溶液与丙物质并不能看到明显的反应现象,原因是_____________。
(共7分)某同学设计了下图所示装置(夹持仪器省略)进行系列实验,实验时将药品A逐滴加入到固体B中,请根据下列实验回答问题:
(1)若A为浓氨水,B为氧化钙,C中盛有AlCl3溶液,旋开活塞E,足够长时间后,观察到C中的现象为,圆底烧瓶中发生反应的化学方程式为;
(2)若A为30%的H2O2溶液,B为二氧化锰,C中盛有酸化过的FeCl2溶液,旋开活塞E后,C中的现象为,圆底烧瓶中发生反应的化学方程式为;
(3)利用上述装置还可以验证SO2的化学性质, A为较浓硫酸,B为亚硫酸钠,则C中盛有
溶液可验证SO2的氧化性; C中盛有溶液可验证其还原性; 而C中盛有溶液可验证其漂白性。
(共8分)A、B、C、D、E、F六种物质的相互转化关系如下图所示,其中反应①是置换反应。
一.若A是常见的金属单质,D、F是气态单质,反应①在水溶液中进行。写出②的离子方程式:_____________________________
二.若A为金属单质,D为非金属单质,且所含元素的原子序数A是D的2倍,原子核外最外层电子数D是A的2倍,③④反应中都有红棕色气体生成,②③④反应中的部分产物已略去。写出①的化学方程式:____写出④的化学方程式:
____ __;在②③④反应中F既表现氧化性又表现酸性的是(填序号)__ ______。
(共6分)A、B、C是中学化学常见的三种有色物质(其组成元素的核电荷数均小于18),其摩尔质量依次减小,它们均能与水发生氧化还原反应,但水既不是氧化剂也不是还原剂。请写出A、B、C分别与水反应的离子方程式。
⑴ A与H2O __________________________________。
⑵ B与H2O _________________________________。
⑶ C与H2O __________________________________。