硅藻土是由硅藻死亡后的遗骸沉积形成的,主要成分是 SiO2和有机质,并含有少量的Al2O3、Fe2O3、MgO 等杂质。精制硅藻土因为吸附性强、化学性质稳定等特点被广泛应用。下图是生产精制硅藻土并获得Al(OH)3的工艺流程。
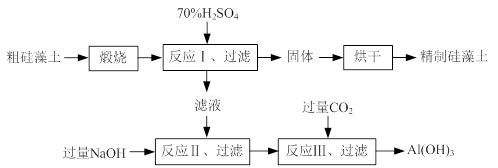
(1)粗硅藻土高温煅烧的目的是 。
(2)反应Ⅱ中加入过量氢氧化钠的作用是 。
(3)反应Ⅲ中生成Al(OH)3沉淀的离子方程式是 ;氢氧化铝常用作阻燃剂,其原因是 。
(3)实验室用酸碱滴定法测定硅藻土中硅含量的步骤如下:
步骤1:准确称取样品a g,加入适量KOH固体,在高温下充分灼烧,冷却,加水溶解。
步骤2:将所得溶液完全转移至塑料烧杯中,加入硝酸至强酸性,得硅酸浊液。
步骤3:向硅酸浊液中加入NH4F溶液、饱和KCl溶液,得K2SiF6沉淀,用塑料漏斗过滤并洗涤。
步骤4:将K2SiF6转移至另一烧杯中,加入一定量蒸馏水,采用70 ℃水浴加热使其充分水解(K2SiF6+3H2O=H2SiO3+4HF+2KF)。
步骤5:向上述水解液中加入数滴酚酞,趁热用浓度为c mol·L-1 NaOH的标准溶液滴定至终点,消耗NaOH标准溶液VmL。
①步骤1中如何判断固体反应完成?请设计实验说明 。
②实验中使用塑料烧杯和塑料漏斗的原因是 。
③步骤3中采用饱和KCl溶液洗涤沉淀,其目的是 。
④样品中SiO2的质量分数可用公式“ ×100%”进行计算。由此分析步骤5中滴定反应的离子方程式为 。
×100%”进行计算。由此分析步骤5中滴定反应的离子方程式为 。
氮元素的单质和化合物在工、农业生产中用途广泛。而汽车尾气中含有NO等多种污染物。
(1)常用作食品袋中填充气的是;(填化学式)常用作制冷剂的化合物是,(填化学式)该物质在空气中与HCl相遇有白烟现象,产生该现象的化学反应方程式是。
(2)铵盐在农业上大多用作化肥。实验室可用固体铵盐NH4Cl与固体Ca(OH)2加热反应来制备氨气,其化学方程式为。
(3)汽车燃料中一般不含氮元素,但尾气却所含有NO,产生的原因用化学方程式表示。
(4)NO对大气的影响之一是导致酸雨,用化学方程式表示NO形成酸雨的原因是。
过氧化氢H2O2(氧的化合价为-1价),俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。对于下列A~D涉及H2O2的反应,填写空白:
| A.Na2O2 +2HCl= 2NaCl+H2O2 |
| B.Ag2O+ H2O2=2Ag+O2+ H2O |
| C.2 H2O2="2" H2O+O2 |
| D.3 H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8 H2O |
(1)H2O2仅体现氧化性的反应是(填代号)。
(2)H2O2既体现氧化性又体现还原性的反应是(填代号)。
(3)B反应式中的氧化产物是。
(4)上述反应说明H2O2、Ag2O、K2CrO4氧化性由强到弱的顺序是:。
将下列性质的代号,填入各小题后面对应的括号中:
| A.脱水性; |
| B.强酸性; |
| C.难挥发性; |
| D.氧化性; |
E.吸水性
(1)将胆矾放入装有浓H2SO4的干燥器中,过一段时间胆矾变白色。()
(2)在烧杯中放入蔗糖,滴入浓H2SO4变黑,并产生大量气体。()
(3)用稀硫酸清洗金属表面的氧化物()
氢氧燃料电池是将H2通入负极,O2通入正极而发生电池反应的,其能量转换率高。
(1)若电解质溶液为KOH,其正极反应为____________________________,
负极反应为__________________________________________。
(2)若电解质溶液为硫酸,其正极反应为______________________,
负极反应为_________________。
(3)若用氢氧燃料电池电解由NaCl和CuSO4组成的混合溶液,其中c(Na+)=3c(Cu2+)=0.3mol·L—1,取该混合液100mL用石墨做电极进行电解,通电一段时间后,在阴极收集到0.112L(标准状况)气体。计算:
①电解池阳极生成氯气的物质的量是mol。
②氢氧燃料电池中转移的电子数目是个
消耗H2的质量是g。(写出计算过程)(保留2位小数)
(17分)已知具有碳碳双键结构的有机物可被碱性高锰酸钾溶液氧化成二元醇,如H2C===CH2 HOCH2CH2OH。现以CH2===C(CH3)2为原料按下列方式合成环状化合物D和高分子化合物G。
HOCH2CH2OH。现以CH2===C(CH3)2为原料按下列方式合成环状化合物D和高分子化合物G。
(1)写出F中官能团名称,
(2)A―→B的反应类型是________,C―→E的反应类型是________,
E―→F的反应类型是________。
D的结构简式是____________,G的结构简式是________。
(3)B―→C的化学方程式是_________________________________________。
(4)E―→F的化学方程式是___________________________________________。
(5)C物质的同分异构体中,与C所含官能团种类和数目都相同的同分异构体有________种(不包括C)。写成其中一种物质的结构简式