(1)某恒温恒容容条件下的可逆反应: △H<O,起始充入amol N2、bmol H2,达到平衡后,N2、H2、NH3的物质的量分别为1 mol、3 mol、10 moL,回答下列问题:
△H<O,起始充入amol N2、bmol H2,达到平衡后,N2、H2、NH3的物质的量分别为1 mol、3 mol、10 moL,回答下列问题:
①a=___________,b=___________。
②平衡后,再充入5 mol NH3,化学平衡将向__________移动(填“左”或“右”或“不移动”),再达新平衡时N2的百分含量_______(填“>”、“<”、“=”)原平衡时N2的百分含量;
③平衡后若升高温度,则平衡向________(填“向左”或“向右”)方向移动;若增加压强,则平衡向________(填“向左”或“向右”)方向移动。
(2)某恒温恒压条件下的可逆反应: ,起始充入1 mol N2、
,起始充入1 mol N2、
3 molH2、16 mol NH3,容器的容积为VL。达到平衡后,N2、H2、NH3的物质的量分别为amol、b mol、cmol,此时容器的容积为.1VL,回答下列问题:
①起始时反应速率v(正)____(填“>”、“<”、“=”)v(逆)。
②平衡时a=________,b=_______。
③若平衡后再充入3.6 mol NH3,重新建立平衡时容器的容积为_____________L。
等物质的量A、B、C、D四种物质混合,发生如下反应: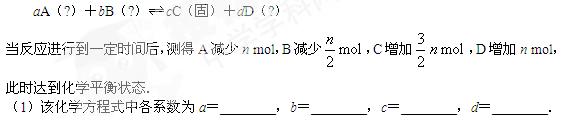
(2)若只改变压强,反应速率发生变化,但平衡不发生移动,则该反应中各物质的聚集状态是:A_________,B_________,D_________.
(3)若只升高温度,反应一段时间后,测知四种物质的量又达到相等,则该反应是
________反应(填“放热”或“吸热”)
Ⅰ。(每空1分,共4分)⑴通常状况下,甲同学取1 mol H2O加热到100℃时,液态水会汽化为水蒸气(如图所示),该过程属于变化。
在保持压强不变的情况下,水蒸气的体积
(填“>”、“<”或“=”)22.4L。
⑵乙同学做H2在O2中燃烧的实验,该实验过程属于变化,在该变化过程中,一定保持相等的是(填序号)。
| A.反应物分子数目与生成物分子数目 | B.反应物原子总物质的量与生成物原子总物质的量 |
| C.反应物总质量与生成物总质量 | D.反应物体积与生成物体积 |
Ⅱ。(每空1分,第3小题2分,共6分)如图所示为常见仪器的部分结构。
⑴请写出下列仪器的名称: A ,B ,C 。
⑵仪器B上标记有(填序号)。
①质量②温度 ③刻度线④浓度⑤容积
③刻度线④浓度⑤容积
⑶检验仪器B是否漏水的方法是
包括4小题,(每空1分,第4小题2分,共10分)
(1)1mol H2SO4中约含有个H2SO4,mol H ,mol O
(2)9.03×1023个CO2的物质的量是mol,在标准状况下的体积L,质量是是克。
(3)在100mL2mol/LH2SO4溶液中,H2SO4的质量是克。H+的物质的量浓度为。
(4)质量分数为36.5%、密度为1.18g/cm3的浓盐酸中HCl的物质的量浓度为。
(每空1分,共4分)已知在标况下的四种气体①6.72LCH4 ②3.01×1023个HCl分子 ③13.6克H2S ④0.2molNH3
用相应的序号填写下列空白:
(1)体积最大的是;(2)密度最大的是;
(3)质量最小的是;(4)含氢原子数最少的是。
有关硫酸亚铁的转化关系如下图所示(无关物质已略去)
已知:①X由两种化合物组成,将X通入品红溶液,溶液褪色;通入BaCl2溶液,产生白色
沉淀。
②Y是红棕色的化合物。若经反应I得到16 g固体Y,产生的气体X恰好被0.4 L 1 mol/L
NaOH溶液完全吸收。
(1)气体X的成分是(填化学式)。
(2)反应I 的反应类型属于(填序号)。
a.分解反应 b.复分解反应 c.置换反应 d.化合反应 e.氧化还原反应
(3)溶液2 中金属 阳离子的检验方法是。
阳离子的检验方法是。
(4)反应IV中生成FeSO4的离子方程式是。