Ⅰ。(每空1分,共4分)⑴通常状况下,甲同学取1 mol H2O加热到100℃时,液态水会汽化为水蒸气(如图所示),该过程属于 变化。
在保持压强不变的情况下,水蒸气的体积 
(填“>”、“<”或“=”)22.4L。
⑵乙同学做H2在O2中燃烧的实验,该实验过程属于 变化,在该变化过程中,一定保持相等的是 (填序号)。
| A.反应物分子数目与生成物分子数目 | B.反应物原子总物质的量与生成物原子总物质的量 |
| C.反应物总质量与生成物总质量 | D.反应物体积与生成物体积 |
Ⅱ。(每空1分,第3小题2分,共6分)如图所示为常见仪器的部分结构。
⑴请写出下列仪器的名称: A ,B ,C 。
⑵仪器B上标记有 (填序号)。
①质量 ②温度  ③刻度线 ④浓度 ⑤容积
③刻度线 ④浓度 ⑤容积
⑶检验仪器B是否漏水的方法是
(每空3分,共9分)请写出下列反应的热化学方程式:
(1)25℃时,1 g甲烷气体完全燃烧生成二氧化碳气体和液态水,放出55.64kJ热量,写出该反应的热化学方程式:。
(2)已知断裂1 mol H2(g)中的H—H键需要吸收436kJ的能量,断裂1 mol O2(g)中的共价键需要吸收498kJ的能量,生成H2O(g)中的1mol H—O键能放出463kJ的能量。试写出O2(g)与H2(g)反应生成H2O(g)的热化学方程式:。
(3)已知:2H2S(g)+O2(g)=2S(s)+2H2O(l)△H=-a kJ·mol-1;
2H2S(g)+3O2(g)=2SO2(g)+2H2O(l)△H=-b kJ·mol-1。
则H2S与SO2两种气体转化为固体硫的热化学方程式为。
在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表: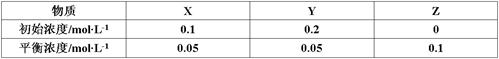
下列说法错误的是
| A.反应达到平衡时,X的转化率为50% |
B.反应可表示为X+3Y 2Z,其平衡常数为1600 2Z,其平衡常数为1600 |
| C.增大压强使平衡向生成Z的方向移动,平衡常数增大 |
| D.改变温度可以改变此反应的平衡常数 |
现以淀粉或乙烯为主要原料都可以合成乙酸乙酯,其合成路线如图所示。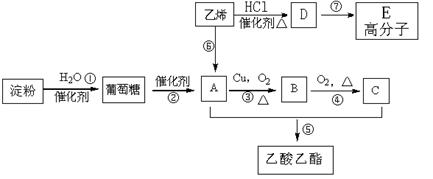
(1)C中含有的官能团名称是;其中⑤的反应类型是;
(2)写出下列反应的化学方程式
①;
③;
⑤;
⑥;
⑦;
A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1个质子,B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层多4个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E主族.
(1)B在周期表中的位置;
(2)E元素形成的最高价氧化物对应的水化物的化学式为;
(3)元素C、D、E形成的离子半径大小关系是>>(用离子符号表示)。
(4)用电子式表示化合物D2C的形成过程。
C、D还可形成化合物D2C2,D2C2含有的化学键是。
(5)由A、B、C三种元素形成的离子化合物的化学式为。
下列物质的转化或分离是用哪种方法实现的?
| A.溶解 | B.裂解 | C.分馏 | D.裂化 E、干馏 |
F、蒸馏 G、电解 H、过滤 I、萃取
请将所选方法的字母代号填在横线上(每一项只填写一种最主要的方法)。
(1)把煤转化为焦炉气、煤焦油和焦炭等
(2)从原油中分离出汽油、煤油、柴油等
(3)将海水淡化
(4)除去粗盐溶液中的泥沙
(5)从海水得到的无水MgCl2中提取金属镁
(6)海水提溴获得的溴水中,提取溴单质