有关硫酸亚铁的转化关系如下图所示(无关物质已略去)
已知:①X由两种化合物组成,将X通入品红溶液,溶液褪色;通入BaCl2溶液,产生白色
沉淀。
②Y是红棕色的化合物。若经反应I得到16 g固体Y,产生的气体X恰好被0.4 L 1 mol/L
NaOH溶液完全吸收。
(1)气体X的成分是(填化学式) 。
(2)反应I 的反应类型属于(填序号) 。
a.分解反应 b.复分解反应 c.置换反应 d.化合反应 e.氧化还原反应
(3)溶液2 中金属 阳离子的检验方法是 。
阳离子的检验方法是 。
(4)反应IV中生成FeSO4的离子方程式是 。
A、B、C、D、E、 F是周期表中短周期的六种元素,有关性质或结构信息如下表:
| 元素 |
有关性质或结构信息 |
| A |
雷雨天大气中会有A的一种单质生成 |
| B |
B离子与A离子电子数相同,且是所在周期中单核离子半径最小的 |
| C |
C与B同周期,且是所在周期中原子半径最大的(稀有气体除外) |
| D |
D是制造黑火药的一种成分,也可用于杀菌消毒 |
| E |
E与D同周期,且在该周期中原子半径最小 |
| F |
F的氢化物和最高价氧化物的水化物反应生成一种离子化合物 |
(1)A与C以原子个数比为1:1形成的化合物的电子式为 ,将0.6 mol该化合物投入到100 mL 3 mol/L BE3溶液中的离子方程式为,。
(2)F的氢化物是由(极性或非极性)键形成的 (极性或非极性)分子,写出实验室制备该氢化物的化学方程式。
(3)下图可用于实验证明D、E的非金属性的强弱。
① 溶液a和b分别为,(写化学式)。
②溶液a与固体a反应的离子方程式为。
③非金属性D E(填大于或小于),请从原子结构的角度解释原因。
对羟基苯甲酸丁酯是一种很好的药剂,工业上常用对羟基苯甲酸与丁醇在浓硫酸催化下进行酯化反应而制得。以下是某课题组开发的从廉价、易得的化工原料出发制备对羟基苯甲酸丁酯的合成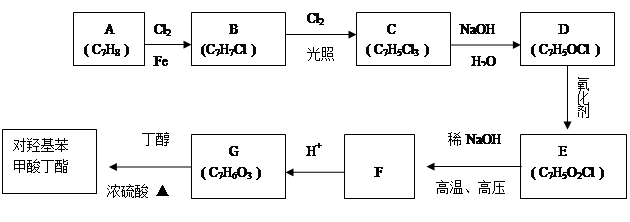
已知以下信息:
①通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基;
②D可与银氨溶液反应生成银镜;
③F的核磁共振氢谱表明其有两种不同化学环境的氢,且峰面积比为1 :1。
回答下列问题:
(1)G中官能团的名称为__________;
(2)B的结构简式为__________;
(3)由C生成D的化学反应方程式为____________________;
(4)由E生成F的化学反应方程式为____________________,
(5)E的同分异构体中含有苯环且能发生银镜反应的共有______种,其中核磁共振氢谱有三种不同化学环境的氢,且峰面积比为2 :2 :1的是___________(写结构简式)。
铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AlF6)混合熔融电解制得。
①铝土矿的主要成分是Al2O3和SiO2等。从铝土矿中提炼Al2O3的流程如下:
②以萤石(CaF2)和纯碱为原料制备冰晶石的流程如下:
回答下列问题:
(1)写出反应1的离子方程式,,
(2)滤液Ⅰ中加入CaO生成的沉淀是(填化学式),反应2(气体A足量)的离子方程式为 ;
(3)电解制铝的化学方程式是;
(4)C为浓硫酸,E为硫酸钙,写出由D制备冰晶石(有A生成)的化学方程式。
某溶液仅含Fe2+、Na+、Al3+、Ba2+、SO42-、NO3-、Cl-中的4种离子,所含离子的物质的量均为0.1mol。若向该溶液中加入过量的稀硫酸,有气体产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。回答下列问题:
(1)若向该溶液中加入过量的稀硫酸和KSCN溶液,现象是:;
(2)写出向该溶液中加入过量的稀硫酸发生反应的离子方程式为:________________________________________________________________________;
(3)经分析,该溶液仅含的4种离子是:______________________________________;
(4)判定另外3种离子不能存在的主要依据有三个:
①向该溶液中加入过量的稀硫酸,有气体产生,且溶液中阴离子种类不变,②所含离子的物质的量均为0.1mol,则③是__________________________________________;
(5) 若向该溶液中加入足量的NaOH溶液,将所得的沉淀过滤再灼烧,最后所得固体的质量为______g
Ⅰ.2009年墨西哥、美国等地出现甲型H1N1流感疫情,引起全世界的关注,这种流感疫情是由甲型H1N1病毒引起的。美国疾病控制和预防中心推荐使用瑞士罗氏制药公司生产的“达菲”胶囊和英国葛兰素—史克公司生产的喷雾式药剂“乐感清”两款药物。
达菲和乐感清的结构简式如下图所示:

请回答下列问题:
(1)乐感清的分子式是____。
(2)合成达菲的主要原料莽草酸(结构简式为 
 )存在于我国盛产的八角茴香中。关于莽草酸性质的描述,下列说法正确的是()
)存在于我国盛产的八角茴香中。关于莽草酸性质的描述,下列说法正确的是()
A. 1 mol莽草酸与足量的金属钠反应可生成4mol H2。
B. 1 mol莽草酸与足量氢氧化钠溶液反应,最多可消耗氢氧化钠4 mol。
C. 1 mol莽草酸与足量的碳酸钠溶液反应可生成二氧化碳气体1 mol。
D. 1 mol莽草酸与足量的碳酸氢钠溶液反应可生成二氧化碳气体1 mol
(3)下列每组中各有三对物质,它们都能用分液漏斗分离的是
A.乙酸乙酯和水,酒精和水,植物油和水
B.四氯化碳和水,溴苯和水,硝基苯和水
C.甘油和水,乙酸和水,乙酸和乙醇
D.汽油和水,苯和水,乙二醇和水
Ⅱ.下图中A、B、C、D、E均为有机化合物。已知:C能跟NaHCO3溶液发生反应,C和D的相对分子质量相等,且E为无支链的化合物。请回答下列问题:
(1)C分子中官能团的名称是 ;化合物B不能发生的反应是 (填字母序号)。
a.加成反应 b.取代反应 c.消去反应
d.酯化反应 e.水解反应 f.氧化反应
(2)反应②的化学方程式是___________________________。(3) A的结构简式是_________________。
(4)同时符合下列三个条件的B的同分异构体的数目有______个。
a含有间二取代苯环结构 b.属于非芳香酸酯 c.可与FeCl3溶液发生显色反应
写出其中任意一个同分异构体的结构简式__________________________________。