硫酸镁在医疗上具有镇静、抗挛等功效。以菱镁矿(主要成分是MgCO3)为主要原料制备硫酸镁的方法如下: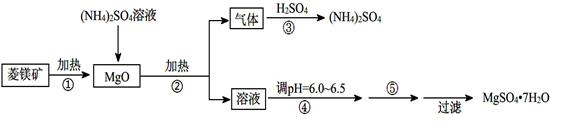
(1)步骤②中发生反应的离子方程式为 。
(2)步骤④中调节pH=6.0~6.5的目的是 。
(3)步骤⑤的操作为
(4)已知酸碱指示剂百里酚蓝变色的pH范围如表所示:
| pH |
< 8.0 |
8.0 ~ 9.6 |
> 9.6 |
| 颜色 |
黄色 |
绿色 |
蓝色 |
25℃时,向Mg(OH)2的饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色
为 [25℃时,Ksp[Mg(OH)2] =5.6×10-12]。
如右图所示,晶体硼的基本结构单元都是由硼原子组成的正二十面体,这个多面体中含有20个等边三角形和一定数目的顶角,每个顶角上各有1个原子。



 (1)这个基本结构单元由个硼原子组成,
(1)这个基本结构单元由个硼原子组成,
 共含有个B—B键。
共含有个B—B键。


 (2)假设将此基本结构单元的每个顶角按一定比例且同等
(2)假设将此基本结构单元的每个顶角按一定比例且同等
 程度地削去(切点不重合),可得到另一个多面体,则此多面体含
程度地削去(切点不重合),可得到另一个多面体,则此多面体含
 个五边形,个六边形。若再设此多面体的每个交点处有一个碳
个五边形,个六边形。若再设此多面体的每个交点处有一个碳
 原子,这样就构成了碳元素形成的一种单质分子,此分子的分子式为。
原子,这样就构成了碳元素形成的一种单质分子,此分子的分子式为。
(1)将NaBiO3固体(黄色微溶)加入到MnSO4和H2SO4的混合溶液里加热,固体溶解变为澄清溶液,发生如下反应:
NaBiO3+ MnSO4+ H2SO4===Na2SO4+ Bi2(SO4)3+ NaMnO4+ H2O
①上述反应中还原产物是,若有2mol氧化剂在该反应中被还原,则生成的MnO4-被还原为Mn2+时,能将molHCl氧化成Cl2;
②写出NaBiO3固体溶于浓盐酸产生黄绿色气体的化学反应方程式。
(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
Cu(S)+2H+(aq)="==" Cu2+(aq)+H2(g) ΔH=64.39kJ·mol-1
2H2O2(L)===2H2O(L)+O2(g) ΔH=-196.46kJ·mol-1
H2(g)+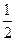 O2(g)===H2O(L) ΔH=-285.84kJ·mol-1
O2(g)===H2O(L) ΔH=-285.84kJ·mol-1
在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为 。
取一定质量的Al粉和一定质量的某种铁的氧化物混合进行铝热反应,两者恰好完全反应。若在反应后混合物中加入足量的稀硫酸,产生H2的体积为V1L,另取相同质量的Al粉,加入足量稀硫酸,产生H2的体积为V2L(V1,V2均在标况下测定),则V2:V1=4:3。另取相同质量的铁的氧化物,加入盐酸溶解,消耗盐酸的物质的量为2.4mol 。则:(1)写出铝热反应方程式(以FexOy表示铁的氧化物)
_______________________________________________________________________。
(2)此铁的氧化物的化学式为_________。
(3)铝粉的物质的量为____________。
已知乙烯能发生以下转化: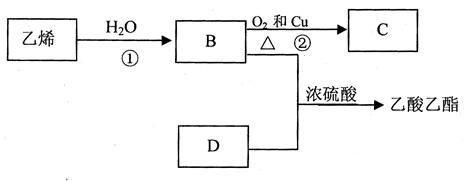
(1)乙烯的结构简式为:_________________________。
(2)写出B、D化合物中官能团:
B中含官能团______________(填名称);D中含官能团____________(填结构简式)
(3)写出反应的化学方程式
①:__________________________________________反应类型:_____________
②:__________________________________________反应类型:_____________
根据以下叙述回答。
能源可划分为一级能源和二级能源。自然界中以现成形式提供的能源称为一级能源;需依靠其他能源的能量间接制取的能源称为二级能源。氢气是一种高效而没有污染的二级能源,它可以由自然界中大量存在的水来制取:
(1)为减少污染,提高燃料利用率,下列措施可以达到目的的是_______
A.城市居民不用天然气而烧煤,烧木柴
B.若将原来烧天然气的灶具改烧液化石油气(成份为C3H8、C4H10),应增大空气进入量或减少液化气的进入量
C.研制燃料电池
D.在农村大力发展沼气
(2)关于用水制取二级能源氢气,以下研究方向不正确的是()
A.构成水的氢和氧都是可以燃烧的物质,因此可研究在水不分解的情况下,使氢成为二级能源
B.设法将太阳光聚焦,产生高温,使水分解产生氢气
C.寻找高效催化剂,使水分解产生氢气,同时释放能量
D.寻找特殊化学物质,用于开发廉价能源,以分解水制氢气
(3)lg 氢气燃烧时约放热142.9KJ ,而1kg汽油燃烧时放热46000KJ。氢气被分认是21世纪替代矿物燃料的理想能源。你认为氢气作为能源的两个主要优点:
____________________,______________________。