X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量最高的元素,Q的核电荷数是X与Z的核电荷数之和,表中E在元素周期表的各元素中电负性最大。请回答下列问题:
(1)X、Y的元素符号依次为 、 ;
(2)XZ2与YZ2分子的立体结构分别是 和 ,
(3)Q的元素符号是 ,它属于第 周期,它的价电子层电子排布式为 ,在形成化合物时它的最高化合价为 ;
(4)用氢键表示式写出E的氢化物溶液中存在的所有氢键 。
用相应的离子方程式说明原因:
(1)配制氯化铁溶液时,往往需要加入少量的稀盐酸:。
(2)热的纯碱溶液可以用来除油污:。
(3)泡沫灭火器中装的是NaHCO3和Al2(SO4)3两种浓溶液,可用来灭火:。
已知难溶电解质在水溶液中存在溶解平衡:
MmAn(s)  mMn+(aq)+nAm-(aq)
mMn+(aq)+nAm-(aq)
Ksp=[c(Mn+)]m×[c(Am-)]n 称为溶度积。
某学习小组欲探究CaSO4沉淀转化为CaCO3沉淀的可能性,查得如下资料:(25℃)
| 难溶电解质 |
CaCO3 |
CaSO4 |
MgCO3 |
Mg(OH)2 |
| Ksp |
2.8×10-9 |
9.1×10-6 |
6.8×10-6 |
1.8×10-12 |
实验步骤如下:
①往100 mL 0.1 mol·L-1的CaCl2溶液中加入100 mL 0.1 mol·L-1的Na2SO4溶液,立即有白色沉淀生成。
②向上述悬浊液中加入固体Na2CO3 3 g,搅拌,静置,沉淀后弃去上层清液。
③再加入蒸馏水搅拌,静置,沉淀后再弃去上层清液。
④_____________________________________________________________________。
(1)由题中信息知Ksp越大,表示电解质的溶解度越(填“大”或“小”)。
(2)写出第②步发生反应的化学方程式:______________________________________。
(3)设计第③步的目的是___________________________________________________。
(4)请补充第④步操作及发生的现象:_____。
称取三份锌,分别放入三支试管中,在试管甲里加入PH=3的盐酸50ml,在试管乙里加入PH=3的醋酸50ml,在试管丙里加入PH=3的醋酸50ml及少量铜粉,塞上导管塞子,定时测定生成H2的体积。若反应终了时,生成的H2一样多,且锌没有剩余。
(1)用“>”、“=”或“<”回答以下问题:
①参加反应的锌的质量由多到少的顺序为:。
②反应完毕时,所需反应时间由多到少的顺序为:。
(2)简答:
①反应所需时间最长的一种酸的原因是:。
②乙、丙反应所需时间是否相等?答:。其原因是:。
已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
| A.c(Cl-)>c(NH4+)>c(H+)>c(OH-) | B.c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| C.c(Cl-)>c(H+)>c(NH4+)>c(OH-) | D.c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
(1)若溶液中只溶解了一种溶质,该溶质的名称是,上述离子浓度大小顺序关系中正确的是(选填序号)。
(2)若上述关系中C是正确的,则溶液中溶质的化学式是。
(3)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)(填“>”、“<”或“=”,下同)c(NH3·H2O),混合后溶液中c(NH4+)与c(Cl-)的 关系c(NH4+)_________c(Cl-)。
对可逆反应aA(g)+bB(g)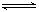 cC(g)+dD(g)达到平衡时,各物质的物质的量浓度满足以下关系:
cC(g)+dD(g)达到平衡时,各物质的物质的量浓度满足以下关系: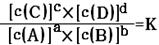 (为一常数),K称为化学平衡常数,它的值只与温度有关。现有反应:CO(g)+H2O(g)
(为一常数),K称为化学平衡常数,它的值只与温度有关。现有反应:CO(g)+H2O(g)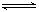 CO2(g)+H2(g),△H<0。在850℃时,K=1。
CO2(g)+H2(g),△H<0。在850℃时,K=1。
(1)若升高温度到950℃时,达到平衡时K1(填“大于”、“小于”或“等于”)。
(2)850℃时,若向一容积可变的密闭容器中同时充入1.0 mol CO,3.0 mol H2O,1.0 mol CO2和x mol H2,则:①当x=5.0时,上述平衡向(填“正反应”或“逆反应”)方向移动。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是。
(3)在850℃时,若设x=5.0和x=6.0,其他物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则ab(填“大于”、“小于”或“等于”)。