5—氨基酮戊酸盐是一种抗肿瘤药,其合成路线如下:

(一)已知:
(1)5—氨基酮戊酸盐中有____种官能团。A分子结构中有一个环,不能使溴水褪色,且只有一种环境的氢原子,则A的结构简式为_____。
(2)G是B的一种同分异构体,能与NaHCO3溶液反应,能发生银镜反应,1molG与足量金属Na反应能生成1molH2,且G分子中不含甲基,符合上述条件的G可能的结构简式有 种。
(3)D→E的反应方程式___________;反应类型为__________________。
(二)已知:
(4)请结合题中所给信息,写出由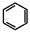 、CH3CH2COOH为原料合成
、CH3CH2COOH为原料合成
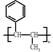 的合成路线流程图(无机试剂任选)。合成路线流程图示例:
的合成路线流程图(无机试剂任选)。合成路线流程图示例:
800℃时,在2 L密闭容器内加入NO和O2,发生反应:2NO(g)+O2(g) 2NO2(g),测得n(NO)随时间的变化如下表,请回答:
2NO2(g),测得n(NO)随时间的变化如下表,请回答:
| 时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)/mol |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)NO的平衡浓度c (NO)=;
(2)用O2表示从0~2s内该反应的平均反应速率为;
(3)下图中表示NO2变化的曲线是;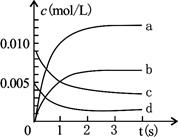
(4)能说明该反应已达到平衡状态的是。
a.容器内气体总物质的量保持不变
b.正反应和逆反应的速率都为0
c.容器内NO、O2、NO2物质的量之比为2∶1∶2
d.容器内NO气体的体积分数不变
下表是元素周期表的一部分,请用元素符号或化学式回答有关问题:
(1)表中化学性质最不活泼的元素是,最活泼的金属元素是,最活泼的非金属元素是。
(2)表中能形成两性氧化物的元素是 ,写出该元素的单质与⑨最高价氧化物的水化物反应的离子方程式。
(3)③⑥⑦三种元素原子半径由大到小的顺序是 。
(4)用电子式表示由元素⑨⑦形成化合物的过程:。
(5)③元素与⑩元素两者核电荷数之差是 。
(6)设计实验方案:比较⑦与⑩单质氧化性的强弱,请将方案填入下表。
| 实验步骤 |
实验现象与结论 |
原电池是直接把化学能转化为电能的装置。
(1)如图1所示:在Cu-Zn原电池中,Zn极发生反应(填“氧化”或“还原”),写出电极反应式。Cu极为极,发生的电极反应为。

(2)请根据化学反应:Cu+2FeCl3=CuCl2+2FeCl2设计原电池,在图2方框内画出装置图,并用离子方程式表示电极反应。
负极反应为。
正极反应为。
(8分)利用化学反应将存储在物质内部的化学能转化为电能,科学家设计出了原电池,从而为人类生产、生活提供能量。
(1)甲同学认为,所有的氧化还原反应都可以设计成原电池,你是否同意(填“是”或“否”)。若不同意,请你试举一例,写出相应的化学方程式:
(2)乙同学依据氧化还原反应:2Ag+ + Cu = Cu2+ + 2Ag设计的原电池如图所示:
①负极的材料是,发生的电极反应为;
②外电路中的电子是从电极流向电极。(写出电极材料的名称)
③当反应进行到一段时间后取出电极材料,测得某一电极增重了5.4g,则该原电池反应共转移了的电子数目是;
④请指出该原电池装置的一个缺点:;
学习了元素周期律的有关知识后,某同学根据元素非金属性与对应最高价含氧酸之间的关系,选择由短周期元素组成的化合物设计了如图装置来一次性完成同主族和同周期元素非金属性强弱比较的实验研究。
(1)写出选用物质的化学式:B、C。
干燥管D的作用是
(2)该装置存在缺陷,请指出:,
改进的方法是:
(3)改进后,进行实验。根据实验目的,烧杯C中发生反应的离子方程式
(4)通过实验得出的结论:元素非金属性强弱顺序为;从原子结构的角度简要分析同周期元素性质递变的原因: