研究证明:使用氯气作自来水消毒剂,氯气会与水中有机物反应,生成如CHCl3等物质,这些物质可能是潜在的致癌致畸物质,目前人们已研发多种饮用水的新型消毒剂。亚氯酸钠(NaClO2)常用于水的消毒和砂糖、油脂的漂白与杀菌。以下是用过氧化氢法生产亚氯酸钠的工艺流程图:

已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O。
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下较安全;
(1)在发生器中鼓入空气的作用可能是_________________________________。吸收塔内发生反应的化学方程式为_____________________。该工艺流程中的NaClO3、ClO2、NaClO2都是强氧化剂,它们都能和浓盐酸反应制取Cl2。若用二氧化氯和浓盐酸制取Cl2,当生成0.5 mol Cl2时,反应中转移电子的个数是________。
(2)吸收塔的温度不能超过20℃,其目的是_____________。吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性物质中除H2O2外,还可以选择的还原剂是_____(选填序号)。
a.Na2O2 b.Na2S c.FeCl2
(3)从滤液中得到的NaClO2·3H2O晶体的操作依次是__________(填写序号)。
a.蒸发 b.灼烧 c.过滤 d.冷却结晶
(4)印染工业常用亚氯酸钠(NaClO2)漂白织物。亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体,25℃时,各组分含量随pH变化情况如图所示(Cl-没有画出)。
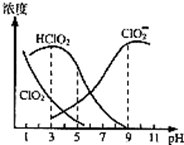
回答下列问题:
①该温度下NaClO2溶液中c(Na+)__________c(ClO2-)(填“>”“=”或“<”),原因是________________________________(用一个离子方程式表示);
②使用该漂白剂的最佳pH为_____;
| A.3.0 | B.4.0-4.5 | C.6.5-7.0 | D.9.0 |
③根据图中数据,当pH=8时,往NaClO2溶液中滴入稀盐酸,溶液中主要反应的离子方程式为_______。
某无色稀溶液X中,可能含有下表所列离子中的某几种。
| 阴离子 |
CO32-、SiO32-、AlO2-、Cl- |
| 阳离子 |
Al3+、Fe3+、Mg2+、NH4+、Na+ |
现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(V)的关系图所示。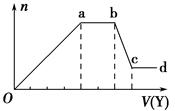
(1)若Y是盐酸,则Oa段转化为沉淀的离子(指来源于X溶液的,下同)是,
ab段发生反应的离子是,bc段发生反应的离子方程式为。
(2)若Y是NaOH溶液,则X中一定含有的离子是,ab段反应的离子方程式为。
某铝合金(硬铝)中含有镁、铜、硅,为了测定该合金中铝的含量,有人设计如下实验:
(1)取样品a g,称取时使用的仪器名称为。
(2)将样品溶于足量稀盐酸中,过滤,滤液中主要含有;滤渣中含有;在溶解过滤时使用的主要玻璃仪器有。
(3)往滤液中加入过量NaOH溶液,过滤,写出该步操作中有关的化学方程式。
(4)在第(3)步的滤液中通入足量CO2,过滤,将沉淀用蒸馏水洗涤数次后,烘干并灼烧至重量不再减少为止,冷却后称量,质量为b g。有关反应的化学方程式为。
(5)该样品中铝的质量分数的表达式为。
纯碱(Na2CO3)在生产生活中具有广泛的用途。以下是实验室模拟制碱原理制取Na2CO3的流程图。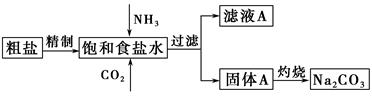
已知:向饱和食盐水中通入NH3、CO2后发生的反应为NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl。请回答以下问题:
(1)粗盐中含有的杂质离子有Ca2+、Mg2+、SO42-等。
精制除杂的步骤顺序是a→→→→b(填字母编号)。
a.粗盐溶解,滤去沉渣
b.加入盐酸调pH
c.加入Ba(OH)2溶液
d.加入Na2CO3溶液
e.过滤
向饱和食盐水中先通入NH3,后通入CO2,理由是。
(2)灼烧固体A制Na2CO3在(填字母序号)中进行。
a.坩埚 b.蒸发皿c.烧杯 d.锥形瓶
证明滤液A中含有NH4+的方法是。
对滤液A进行重结晶能够获得NH4HCO3,向pH=13含Na+、K+的溶液中加入少量NH4HCO3使pH降低,反应的离子方程式为。
(3)下图装置中常用于实验室制备CO2的是(填字母编号);用b装置制备NH3,分液漏斗中盛放的试剂是(填试剂名称),烧瓶内可加入的固体试剂是(填试剂名称)。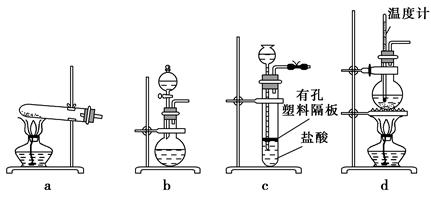
(4)一种天然碱晶体成分是aNa2CO3·bNa2SO4·cH2O,某同学利用下列提供的试剂,设计了如下简单合理测定Na2CO3的质量分数的实验方案。(仪器自选)请把实验方案填全:
供选择的试剂:1.0 mol·L-1 H2SO4溶液、1.0 mol·L-1 BaCl2溶液、稀氨水、碱石灰、Ca(OH)2溶液、蒸馏水
①称取m1g天然碱晶体样品,溶于适量蒸馏水中。
②。
③。
④计算天然碱晶体中含Na2CO3的质量分数。
镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的。某学校课外兴趣小组从海水晒盐后的盐卤(主要含Na+、Mg2+、Cl-、Br-等)中模拟工业生产来提取镁,主要过程如下: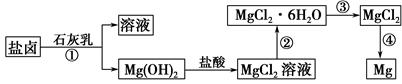
回答下列问题:
(1)工业上从盐卤中获取Mg(OH)2用石灰乳而不用NaOH溶液的原因是。
(2)从过程①得到的Mg(OH)2沉淀中混有少量的Ca(OH)2,除去少量Ca(OH)2的方法是先将沉淀加入到盛有溶液的烧杯中,充分搅拌后经、(填操作方法)可得纯净的Mg(OH)2。
(3)下图是该兴趣小组设计进行过程③的实验装置图: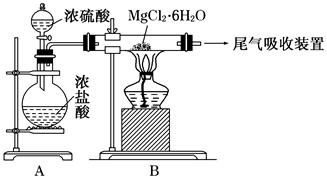
其中装置A的作用是。
(4)写出过程④中发生反应的化学方程式。
某研究性学习小组就Na2O2的有关性质探究如下:向滴有酚酞的水中投入一定量的Na2O2,观察到先有大量气泡产生,溶液变红,过一会儿溶液又变为无色。
对上述实验中溶液变红,过一会儿又褪色的原因,甲、乙两同学提出了不同的解释:
甲同学认为是Na2O2与水反应放出氧气,氧气有氧化性,将酚酞氧化而使溶液褪色;
乙同学则认为是Na2O2与水反应时产生了H2O2,H2O2的强氧化性使酚酞褪色。
(1)乙同学设计了如下实验来证明自己的猜想是正确的:在滴有酚酞的氢氧化钠溶液中滴加3%的H2O2溶液并振荡。
①若乙同学的猜想正确,可观察到的现象是。
②甲同学针对乙同学的上述验证实验提出还应增做实验才能更直接证明Na2O2与水反应生成了H2O2,甲同学提出要增加的实验是什么?
(2)试设计简单实验证明甲同学的解释是否正确(画出简易装置图,说明简要步骤)。