X、Y、Z、W四种常见元素,其中X、Y、Z为短周期元素。有关信息如下表:
| |
原子或分子相关信息 |
单质及其化合物相关信息 |
| X |
ZX4分子是由粗Z提纯Z的中间产物 |
X的最高价氧化物对应的水化物为无机酸中最强酸 |
| Y |
Y原子的最外层电子数等于电子层数 |
Y的氧化物是典型的两性氧化物,可用于制造一种极有前途的高温材料 |
| Z |
Z原子的最外层电子数是次外层电子数的1/2 |
Z是无机非金属材料的主角,其单质是制取大规模集成电路的主要原料 |
| W |
W原子的最外层电子数小于4 |
W的常见化合价有+3、+2,WX3稀溶液呈黄色 |
(1)W在周期表的位置为 ,W(OH)2在空气中不稳定,极易被氧化,由白色迅速变成灰绿色,最后变成红褐色,反应的化学方程式为 。
(2)X的简单阴离子的结构示意图为 ,X的最高价氧化物对应水化物的水溶液与Y的氧化物反应的离子方程式为 。
(3)Z的氧化物在通讯领域用来作 ,工业上制备Z的单质的化学反应方程式为 。锗与Z是同一主族元素,门捷列夫曾预言了这一元素的存在,它用来制造半导体晶体管,最新研究表明:有机锗具有明显的抗肿瘤活性,锗不与NaOH 溶液反应但在有H2O2存在时可与NaOH 溶液反应生成锗酸盐,其方程式为 。
(4)在50 mL l mol·L-1的YX3溶液中逐滴加入0.5 mol·L-1的NaOH溶液,得到1.56 g沉淀,则加入NaOH溶液的体积最多为 mL。
(12分)有机物A-H能发生下图所示一系列变化
试回答下列:
(1)写出结构简式:
A____________________B__________________________C______________________
D_____________________
(2)写出化学方程式:
①____________________________________ _______
②____________________________________________
已知A、D、F为常见的单质,其它物质均为化合物。又知D与F、C与L相对分子质量相同,G→H是化工生产中的重要反应。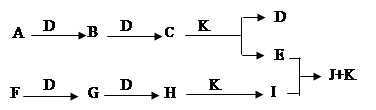
回答下列问题:
(1)写出C、H、L的化学式:CHL。
(2)用电子式表示C的形成过程 _________。
(3)足量的C与K反应生成1molD时,转移电子mol。
(4)化工生产中实现G→H时,选择的适宜条件是 _____
__________________________。
现有A、B、C、D、E五种盐溶液,分别由 、
、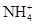 、
、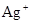 、
、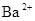 、
、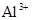 、
、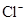 、
、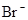 、
、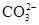 、
、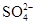 、
、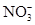 中的阳离子和阴离子各一种组成(五种盐所含阴、阳离子各不相同).已知:①A+B→白↓②A+D→白↓③B+C→白↓+↑④D+C→白↓⑤A溶液中
中的阳离子和阴离子各一种组成(五种盐所含阴、阳离子各不相同).已知:①A+B→白↓②A+D→白↓③B+C→白↓+↑④D+C→白↓⑤A溶液中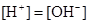 ⑥B溶液中
⑥B溶液中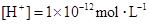 ⑦C、D、E三种溶液的pH<7,根据以上实验事实可以推出(用分子式表示)A为___________________;B为__________________;C为___________________;D为__________________;E为___________________。
⑦C、D、E三种溶液的pH<7,根据以上实验事实可以推出(用分子式表示)A为___________________;B为__________________;C为___________________;D为__________________;E为___________________。
写出④反应的离子方程式:_____________________________________________________
(7分)A、B、C、D、E为原子序数依次增大的同周期主族元素,已知A、C、E三原子的
最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水,D元素原子的最外层电子数比次外层电子数少4,回答:
(1)写出下列元素的符号: B ____,C ____,E ____;
(2)D的常见固态氧化物是 __晶体, 每n mol该氧化物晶体中含D—O键共为 _______mol;
(3) A、C两种元素最高价氧化物的水化物反应的离子方程式:
________________________________________________________________。
某混合溶液中可能含有的离子如下表所示:
| 可能大量含有的阳离子 |
H+、Ag+、Mg2+、Al3+、NH4+、Fe3+ |
| 可能大量含有的阴离子 |
Cl-、Br-、I-、CO32-、AlO2- |
为探究其成分,进行了以下探究实验。
(1)探究一:
甲同学取一定量的混合溶液,向其中逐滴加入氢氧化钠溶液,产生沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)的关系如右图所示。
①该溶液中一定含有的阳离子是____________,其对应物质的量浓度之比为________,一定不存在的阴离子是_____________;
②请写出沉淀减少过程中发生反应的离子方程式____________________________。
(2)探究二:
乙同学检测到该溶液中含有大量的Cl-、Br-、I-,若向1 L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,分析后回答下列问题:
| Cl2的体积(标准状况) |
5.6 L |
11.2 L |
22.4 L |
| n (Cl-) |
2.5 mol |
3.0 mol |
4.0 mol |
| n (Br-) |
3.0 mol |
2.8 mol |
1.8 mol |
| n (I-) |
x mol |
0 |
0 |
①当通入Cl2的体积为5.6 L时,溶液中发生反应的离子方程式为_______________;
②原溶液中Cl-、Br-、I-的物质的量浓度之比为______________________。