在容积不变的密闭容器中,一定条件下发生反应:2A(?) B(g)+C(s),达到化学平衡后,升高温度,容器内气体的密度增大,则下列叙述正确的是
B(g)+C(s),达到化学平衡后,升高温度,容器内气体的密度增大,则下列叙述正确的是
| A.若正反应是吸热反应,则A为非气态 |
| B.若正反应是放热反应,则A为非气态 |
| C.在平衡体系中加入少量C,该平衡向逆反应方向移动 |
| D.改变压强对该平衡的移动一定无影响 |
已知(1)H2O(g) ==H2O(l) ΔH1=-Q1 kJ·mol-1
(2)CH3OH(g) ==CH3OH(l) △H2=-Q2 kJ·mol-1
(3)2CH3OH(g) +3O2(g) ==2CO2(g)+4H2O(g) △H3=-Q3 kJ·mol-1
(Q1、Q2、Q3均大于0)若要使32g液态甲醇完全燃烧,最后恢复到室温,放出的热量为(单位:kJ)
| A.Q1+ Q2 + Q3 | B.0.5 Q3-Q2+2Q1 | C.0.5 Q3+ Q2-2Q1 | D.0.5(Q1+Q2+Q3) |
如下图所示,△H1=-393.5 kJ•mol-1,△H2=-395.4 kJ•mol-1,下列说法或表示式正确的是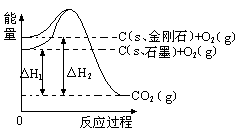
| A.C(s、石墨)=C(s、金刚石) △H=" +1.9" kJ•mol-1 |
| B.石墨和金刚石的转化是物理变化 |
| C.金刚石的稳定性强于石墨 |
| D.1 mol石墨的总键能比1 mol金刚石的总键能小1.9 kJ |
现有下列两个图象: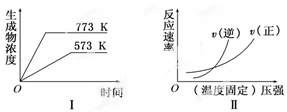
下列反应中符合上述图象的是
A.N2(g)+3H2(g)  2NH3(g) ΔH<0 2NH3(g) ΔH<0 |
B.2SO3(g)  2SO2(g)+O2(g)ΔH>0 2SO2(g)+O2(g)ΔH>0 |
C.4NH3(g)+5O2(g)  4NO(g)+6H2O(g) ΔH<0 4NO(g)+6H2O(g) ΔH<0 |
D.H2(g)+CO(g)  C(s)+H2O(g)ΔH>0 C(s)+H2O(g)ΔH>0 |
恒温下,反应aX(g) bY(g) + cZ(g) 达到平衡状态,把容器体积压缩到原来的1/2,且达到新的平衡状态时,X的物质的量浓度从0.1mol/L增大到0.19mol/L,下列判断正确的是
bY(g) + cZ(g) 达到平衡状态,把容器体积压缩到原来的1/2,且达到新的平衡状态时,X的物质的量浓度从0.1mol/L增大到0.19mol/L,下列判断正确的是
| A.a>b+c | B.a<b+c | C.a=b+c | D.a=b=c |
反应2A(g)  2B(g) +C(g)△H>0达平衡时,要使A的浓度增大且v正降低,应采取的措施是
2B(g) +C(g)△H>0达平衡时,要使A的浓度增大且v正降低,应采取的措施是
| A.加压 | B.减压 | C.减小C的浓度 | D.降温 |