在Na2S、KOH、CH4、Cl2、Na2O2、H2O2、NH4Cl中,只含有离子键的是__________,只含有极性键的是__________,含有非极性键的是__________,既含有离子键又有共价键的是______________________
(1)8 g CH4的物质的量为,在标准状况下所占的体积约为;
(2)100mL 1 mol·L-1Al2(SO4)3溶液中含Al3+离子mol,含SO42-离子个。
(3)0.6mol O2与0.4mol O3质量之比为,分子个数之比为,原子个数之比,它们在同温同压下的体积比是。
实验室用氯化钠固体配制1.00 mol/L的NaCl溶液0.5 L,回答下列问题:
(1)请写出该实验的实验步骤:
①,②,③,④,⑤,⑥。
(2)所需仪器为:托盘天平、还需要那些实验仪器才能完成该实验,请写出:。
(3)试分析下列操作对所配溶液的浓度有何影响及造成该影响的原因。
定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度。对所配溶液浓度的影响:,原因是:。
就有关物质的分离回答下列问题:
(1)现有一瓶A和B的混合液,已知它们的性质如下表。
| 物质 |
熔点/℃ |
沸点/℃ |
密度/g·cm-3 |
溶解性 |
| A |
-11.5 |
198 |
1.11 |
A、B互溶,且均易溶于水 |
| B |
17.9 |
290 |
1.26 |
据此分析,将A和B相互分离的常用方法是:。
(2)在分液漏斗中用一种有机溶剂提取水溶液里的某物质时,静置分层后,如果不知道哪一层液体是“水层”,试设计一种简便的判断方法:。
在K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2O反应中,是氧化剂,是还原剂,元素被氧化,元素被还原,若0.3mol氯气生成则若0.3mol氯气生成转移的电子数目为。
在300 mL2mol/LH2SO4溶液中,溶质的质量是,此溶液中含H+的物质的量是,H+的物质的量浓度是,其中含有个SO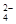 ,SO
,SO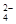 的物质的量浓度是。
的物质的量浓度是。