白磷与氧气可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:P—P akJ·mol—1、P—O bkJ·mol—1、P="O" ckJ·mol—1、O=O dkJ·mol—1。根据图示的分子结构和有关数据计算1mol白磷完全燃烧放出的热量,其中正确的是( )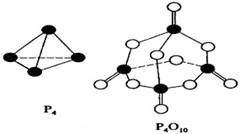
| A.(6a+5d–4c–12b)kJ |
| B.(4c+12b–6a–5d)kJ |
| C.(4c+12b–4a–5d)kJ |
| D.(4a+5d–4c–12b)kJ |
下列叙述中,正确的是
| A.含金属元素的离子一定都是阳离子 |
| B.在氧化还原反应中,非金属单质一定是氧化剂 |
| C.某元素从化合态变为游离态时,该元素一定被还原 |
| D.金属阳离子被还原不一定得到金属单质 |
下列离子方程式的书写,正确的是
| A.实验室用大理石和稀盐酸制取CO2:2H+ + CO32- = CO2↑+ H2O |
B.氢氧化钡溶液与盐酸反应:OH-+H+ =  H2O H2O |
| C.三氯化铁溶液中加入铁粉: Fe3++ Fe= 2Fe2+ |
| D.钠投入水中:Na +H2O = Na+ + OH- + H2↑ |
下列叙述中,正确的是
| A.H2SO4的摩尔质量是98 |
| B.等物质的量的O2和O3中所含的氧原子数相同 |
| C.将98g H2SO4溶解于500mL水中,所得溶液中硫酸的物质的量浓度为2 mol·L-1 |
| D.等质量的CO与CO2中所含碳原子数之比为11︰7 |
2004年4月16日,重庆天原化工总厂发生了氯气泄漏及爆炸特大事故,喷出的氯气造成了多人伤亡。作为现场的消防干警下列处理方法和过程较合理的是:
①及时转移疏散人群,同时向有关部门如实报告事故的有关情况;②被转移人群应戴上用浓NaO H溶液处理过的口罩(湿润);③用高压水枪向空中喷洒含碱性物质的水溶液解毒;④被转移人群可戴上用Na2CO3处理过的口罩(湿润);⑤将人群转移到地势较低的地方;⑥及时清理现场,检查水
H溶液处理过的口罩(湿润);③用高压水枪向空中喷洒含碱性物质的水溶液解毒;④被转移人群可戴上用Na2CO3处理过的口罩(湿润);⑤将人群转移到地势较低的地方;⑥及时清理现场,检查水 源和食物等是否被污染;⑦常温下氯气能溶于水,所以只要向空气中喷洒水就可以解毒。
源和食物等是否被污染;⑦常温下氯气能溶于水,所以只要向空气中喷洒水就可以解毒。
| A.②③④⑤ | B.①③④⑥ | C.①②⑤⑥ | D.①③⑤⑦ |
根据下列反应判断氧化剂的氧化 性由强到弱的顺序,正确的是
性由强到弱的顺序,正确的是
① Cl2+2KI ══ I2+2KCl② 2FeCl3+2HI ══ I2+2FeCl2+2HCl
③ 2FeCl2+Cl2══ 2FeCl3④ I2+SO2+2H2O ══ 2HI+H2SO4
| A.Cl2>I2>Fe3+>SO2 | B.Cl2>Fe3+>I2>SO2 |
| C.Fe3+>Cl2>I2>SO2 | D.Cl2>Fe3+>SO2>I2 |