稀土是工业味精,邓小平说过“中东有石油,我们有稀土”。稀土元素铈(Ce)主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应。已知:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+。下列说法正确的是( )
| A.已知Ce原子序数是58,则其为镧系元素 |
B.铈有四种稳定的核素 Ce、 Ce、 Ce、 Ce、 Ce、 Ce、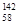 Ce,它们互为同位素 Ce,它们互为同位素 |
| C.用Ce(SO4)2溶液可与硫酸亚铁溶液反应,其离子方程式为:Ce4++2Fe2+=Ce3++2Fe3+ |
| D.铈溶于氢碘酸的化学方程式可表示为:Ce+4HI=CeI4+2H2↑ |
对于反应H— + NH3 =H2 + NH2— 的正确说法是()
| A.属于置换反应 | B.H—是氧化剂 |
| C.NH3是还原剂 | D.H2既是氧化产物又是还原产物 |
下列变化,加入氧化剂才能实现的是 ( )
| A.FeO → Fe2O3 | B.CO2 → CO | C.H2S → Na2S | D.AlCl3 → Al(OH)3 |
下列各组物质,按电解质、非电解质、既不是电解质也不是非电解质顺序排列的是()
| A.硝酸钾、硫酸铜、稀硫酸 | B.空气、水、稀硫酸 |
| C.氯化钠、乙醇、铜 | D.硝酸、食盐水、烧碱 |
符合右图中阴影部分的物质是()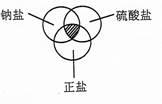
| A.Na2SO3 | B.Na2SO4 | C.K2SO4 | D.NaHSO4 |
下列叙述不正确的是 ()
| A.铝是地壳中含量最多的金属元素 |
| B.铝在空气中能稳定存在,是因为表面覆盖着保护膜 |
| C.实验室制备Al(OH)3,常用铝盐溶液与NaOH反应 |
| D.Al(OH)3是一种医用胃酸中和剂 |