符合右图中阴影部分的物质是( )
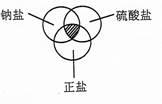
| A.Na2SO3 | B.Na2SO4 | C.K2SO4 | D.NaHSO4 |
常温下,下列有关叙述正确的是()
| A.0.1 mol·L-1醋酸溶液加水稀释后,各离子浓度均减小 |
| B.pH=7的NH4Cl和氨水混合溶液中,c(NH+4)=c(Cl—) |
| C.加热滴有酚酞的CH3COONa溶液,溶液颜色变浅 |
| D.0.1 mol·L-1 Na2CO3溶液中,c(HCO—3)>c(OH—) |
臭氧是常见的强氧化剂,广泛用于处理。制取臭氧的方法之一是电解纯水(原理如下图)。电极b反应如下:

下列说法不正确的是()
| A.电极b为阳极 |
| B.可用Pt作b的电极材料 |
C.电极a反应式: |
| D.电极b附近的溶液呈碱性 |
已知: (Z的物质的量分数)随温度T的变化如下图所示。下列判断正确的是()
(Z的物质的量分数)随温度T的变化如下图所示。下列判断正确的是()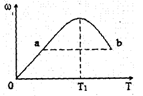
| A.T1时,v正>v逆 |
| B.正反应的△H<0 |
| C.a、b两点的反应速率va=vb |
| D.T<T1时,ω增大的原因是平衡向正方向移动 |
常温下,下列溶液一定呈碱性的是()
| A.pH=11的NaOH溶液与pH=3的CH3COOH溶液等体积混合 |
| B.0.1mol·L-1盐酸和0.1mol·L-1氨水等体积混合 |
| C.0.1mol·L-1氨水和0.1mol·L-1氯水铵溶液等体积混合 |
| D.一定体积pH=5的稀硫酸加水稀释103倍 |
反应: 下列说法不正确的()
下列说法不正确的()
| A.Y是SO2-4 |
B.a=8 |
| C.Cr2O2—7被氧化 | |
| D.生成1molCr3+时转移的电子数是3×6.02×1023 |