(9分)以下是元素周期表的一部分,请回答有关问题:
| |
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
0 |
| 2 |
|
|
|
|
① |
|
② |
|
| 3 |
|
③ |
④ |
⑤ |
|
⑥ |
⑦ |
⑧ |
| 4 |
⑨ |
|
|
|
|
|
⑩ |
|
(1) ⑧和⑤的元素符号是______和_______;
(2)表中最活泼的非金属是______,金属性最强的元素是______;(填写元素符号,下同)
(3)表中能形成两性氢氧化物的元素是_______,分别写出该元素的氢氧化物与⑥、⑨的最高价氧化物对应水化物反应的离子方程式:_________________________________________,
__________________________________________;
(4)请设计一个实验方案,证明⑦、⑩单质氧化性的强弱:__________________________。
某无色溶液可能由KNO3、NH4Cl、Na2CO3、CaCl2中的一种或几种混合而成。往溶液中加入烧 碱溶液并微热,则放出能使湿润的红色石蕊试纸变蓝的气体;另取原溶液加入稀H2SO4有气体放出。据此分析该溶液中一定有、;可能有;一定没有;若要确定可能有的物质可通过确定(填操作名称)。
碱溶液并微热,则放出能使湿润的红色石蕊试纸变蓝的气体;另取原溶液加入稀H2SO4有气体放出。据此分析该溶液中一定有、;可能有;一定没有;若要确定可能有的物质可通过确定(填操作名称)。
1~18号元素有A、B、C、D四种元素,A元素原子最外层电子数比次外层电子数少5个;B元素的原子其第三层电子数比第二层少1个电子;C元素的原子得到2个电子,D元素的原子失去1个电子,所得到的微粒都具有与氖原子相同的电子层结构。回答下列问题:
⑴上述四种元素中A的元素符号是, C元素的名称是。
⑵画出B离子、D原子的结构示意图 ____________, ____
____
在无土栽培中,配制1L内含0.5mol NH4+、0.64mol Cl-、0.56 mol K+、mol SO42-的某中性营养液,若用KCl、NH4Cl、配制,则需这三种固体的物质的量分别为 0.56 mol、0. 08 mol、mol。
(1)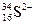 微粒中的质子数是_______,中子数是______
微粒中的质子数是_______,中子数是______ _,核外电子数是_______。
_,核外电子数是_______。
(2) 1.5mol CO2中含_____ mol碳原子,________个氧原子(以NA为阿伏加德罗常数的值),标准状况下的体积为___________L。
(3)在一定温度和压强下 ,5体积气体A2跟15体积的气体B2完全化合生成10体积某气体C,则该气体C的化学式为(用A、B表示)__________。
,5体积气体A2跟15体积的气体B2完全化合生成10体积某气体C,则该气体C的化学式为(用A、B表示)__________。
利用某炉渣(只含Fe2O3、FeO、SiO2、Al2O3)可制备新型净水剂碱式氯化铝[Al2(OH)nCl6-n] 和Fe2O3。工艺流程如下:
①用3.00mol/L的盐酸稀盐酸 浸取炉渣,过滤.
浸取炉渣,过滤.
②滤液先用H2O2氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3
③将第②步分离出沉淀的滤液通CO2调pH值后,保持温度在90~100℃进行“蒸发浓缩”,可以得到碱式氯化铝[Al2(OH)nCl6-n]
据以上信息回 答下列问题:
答下列问题:
(1)实验室配制3.00mol/L的盐酸100mL需要36.5%的浓盐酸(密度为1.2g/cm 3) _____mL,配制用到的仪器有烧杯、玻璃棒、量筒、胶头滴管、。
3) _____mL,配制用到的仪器有烧杯、玻璃棒、量筒、胶头滴管、。
(2)写出H2O2与滤液反应的化学方程式
(3) “蒸发浓缩”需保持温度在90~100℃,可采用的加热方法是
(4)为验证炉渣中含有Fe2O3,做如下实验:
a取适量炉渣于烧杯中,加足量溶解、静置
b取上层清液少量于试管中,滴加,观察现象。选用提供的试剂,
提供的试剂:①稀硝酸 ②稀硫酸 ③氯水 ④ KMnO4溶液 ⑤ KSCN溶液
KMnO4溶液 ⑤ KSCN溶液
步骤a、b中所加试剂分别为;
步骤b中反应的离子方程式: