下图是实验室中制备气体或验证气体性质的装置图
(1)仪器a的名称是 。
(2)利用上图装置制备纯净、干燥的氯气。
①圆底烧瓶内发生反应的离子方程式为 。
②装置B中的溶液为 ;烧杯中溶液的作用为 。
(3)利用上图装置证明SO2具有漂白性、还原性及生成气体中含有CO2。
圆底烧瓶内加入碳,a中加入浓硫酸,B、D中匀为少量品红溶液,C中为足量酸性高锰酸钾溶液,E中为澄清石灰水。
①证明SO2具有漂白性的装置是 ,现象是 ;
②证明SO2具有还原性的现象是 ;
③证明生成气体中含有CO2的现象是 ;
④D装置的作用是 。
为了确定乙醇分子的结构简式是CH3—O—CH3还是CH3CH2OH,实验室利用下图所示的实验装置,测定乙醇与钠反应(ΔH<0)生成氢气的体积,并据此计算乙醇分子中能与金属钠反应的氢原子的数目。试回答下列问题: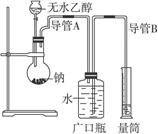
(1)指出实验装置中的错误_____________________________________________________。
(2)若实验中用含有少量水的乙醇代替相同质量的无水乙醇,相同条件下,测得的氢气体积将_________________(填“偏大”“偏小”或“不变”)。
(3)请指出能使该实验安全、顺利进行的关键实验步骤(至少指出两个关键步骤)________________________________________________________________________。
为了测定一种气态烃A的分子式,取一定量的A置于一密闭容器中燃烧,定性实验表明产物是CO2、CO和水蒸气。学生甲、乙设计了两个方案,均认为根据自己的方案能求出A的实验式。他们测得的有关数据如下(箭头表示气流的方向,实验前系统内的空气已排尽):
甲:燃烧产物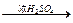 浓H2SO4增重2.52 g
浓H2SO4增重2.52 g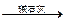 增重1.32 g
增重1.32 g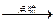 生成CO2 1.76 g
生成CO2 1.76 g
乙:燃烧产物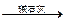 增重5.60 g
增重5.60 g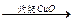 增重0.64 g
增重0.64 g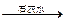 增重4 g
增重4 g
试完成下列问题:
(1)根据两方案,你认为能否求出A的实验式?
(2)请根据你选择的方案,通过计算求出A的实验式。
(3)若要确定A的分子式,是否需要测定其他数据?说明原因。
已知某种燃料含有碳、氢、氧三种元素。为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的氧气中燃烧,并使产生的气体全部通入如上图所示的装置,得到如下表所列的实验结果(假设产生的气体完全被吸收):
| 实验前 |
实验后 |
|
| (干燥剂+U形管)的质量 |
101.1 g |
102.9 g |
| (石灰水+广口瓶)的质量 |
312.0 g |
314.2 g |
根据实验数据完成下列问题:
(1)实验完毕后,生成物中水的质量为_______________g,假设广口瓶里生成一种正盐,其质量为_______________ g。
(2)生成的水中氢元素的质量为_______________ g。
(3)生成的二氧化碳中碳元素的质量为_______________ g。
(4)该燃料中碳元素与氢元素的质量比为_______________。
(5)已知这种燃料的每个分子中只能含有一个氧原子,则该燃料的分子式为______________,结构简式为_______________。
已知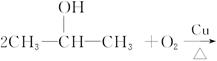
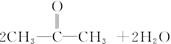
CH22CH3CH2OH+O2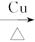 2CH3CH2CHO+2H2O
2CH3CH2CHO+2H2O
C3H7X+NaOH C3H7OH+NaX
C3H7OH+NaX
试参考以上反应及有关物质的性质,用实验确定某卤代烃C3H7X分子中X的位置和种类(X可能是Cl、Br、I三种原子中的一种)。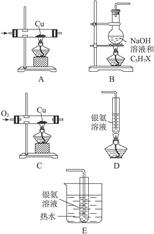
图6-14
(1)试从图6-14中选出适当的几种实验装置并连成一整套,以达到上述实验目的(用编号回答并用→连接)___________。
(2)反应完毕后,若盛有银氨溶液的试管中有银镜产生,则C3H7X的结构简式为___________;再取少量B烧瓶中的液体,冷却并用稀硝酸酸化后,再滴入___________,若产生淡黄色沉淀,则X为___________原子。
如下图所示为实验室制取少量溴苯的装置,完成下列问题: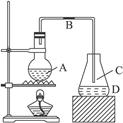
(1)烧瓶A中装的物质为____________________________________,发生反应的化学方程
式为________________________________。
(2)导管B的主要作用是______________________________________________。
(3)导管C处附近会出现白雾,其原因是
____________________________________________。
(4)反应后,向锥形瓶中滴加AgNO3溶液时,观察到的现象是_____________________,相应的离子方程式为______________________________________________。
(5)反应后,将烧瓶A中的液体倒入盛有冷水的烧杯中,烧杯底部有___________色的油状液体,带颜色的原因是________________________________,可用__________________的方法将颜色除去。