下列关于物质性质的比较,不正确的是
| A.酸性强弱:HIO4 >HBrO4> HClO4 | B.原子半径大小:Na> S >O |
| C.热稳定性:HCl>H2S>PH3>AsH3 | D.碱性强弱:KOH > NaOH > LiOH |
含有分子数为b的某气体质量为a g,则V L标况下的该气体的质量为(式中NA为阿伏伽德罗常数)()
A.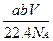 g g |
B. g g |
C.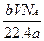 g g |
D.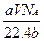 g g |
下列关于溶液和胶体的叙述,正确的是()
| A.溶液是电中性的,胶体是带电的 |
| B.通电时,溶液中的溶质粒子分别向两极移动,胶体中的分散质粒子向某一极移动 |
| C.溶液中溶质粒子的运动有规律,胶体中分散质粒子的运动无规律,即布朗运动 |
| D.一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者则没有 |
分类是学习和研究化学的一种常用的科学方法。下列分类合理的是()
①根据酸分子中含有的H原子个数将酸分为一元酸、二元酸等
②根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应
③根据电解质在熔融状态下能否完全电离将电解质分为强电解质和弱电解质
④根据元素原子最外层电子数的多少将元素分为金属和非金属
⑤根据反应的热效应将化学反应分为放热反应和吸热反应
| A.②③ | B.②⑤ | C.①②④ | D.②③④⑤ |
某饱和一元醛和饱和一元酮的混合物共3.0g,跟足量的银氨溶液完全反应后,可还原出16.2 g银。下列说法中正确的是()
| A.混合物中一定含有甲醛 | B.混合物中可能含有乙醛 |
| C.混合物中醛与酮的质量比为1∶3 | D.混合物中一定含有丙酮 |
下 列物质中,分子里的所有原子不可能在同一平面上的是()
列物质中,分子里的所有原子不可能在同一平面上的是()
| A.乙炔 | B.苯甲醛 | C.异戊二烯 | D.苯乙烯(CH2 =CH—C6H5) =CH—C6H5) |