(16分)请你参与下列探究。
【问题情景】某化学实验小组同学将铁粉投入硫酸铜溶液中,发现生成红色固体物质的同时,有较多的气泡放出。这一现象激发起同学们的探究欲望,生成的是什么气体呢?
【提出猜想】从物质组成元素的角度分析,放出的气体可能是SO2、O2、H2。
【查阅资料】SO2易溶于水,它能与NaOH溶液反应,生成Na2SO3。
【方案设计】依据上述猜想,实验小组同学分别设计了如下方案:
(1)甲同学认为是O2,则检验方法是 。
(2)乙同学认为是SO2,则只需将放出的气体通入盛有NaOH溶液的洗气瓶中,称量通气前后洗气瓶的质量。写出SO2与NaOH反应的化学方程式: 。
(3)实验小组同学合作设计了如下组合实验方案,排除和验证猜想的气体。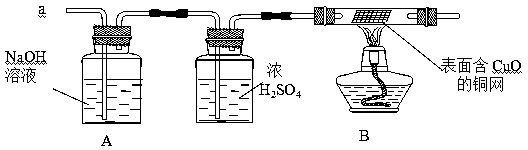
如果放出的是O2和H2的混合物,你认为方案中的安全隐患是 。
丙同学认为:为确保安全,实验前应先进行验纯操作。
【实验探究】经丙同学确认安全后,小组同学首先对装置A进行称量,再将收集到的气体从a通入,过一会儿点燃B处酒精灯;一段时间后,发现表面含CuO的铜网由黑色变为光亮的红色;停止通气,再次称量装置A,发现质量不变。
结论:(1)铁粉与硫酸铜溶液反应时,产生的气体是 。
(2)写出该气体与CuO反应的化学方程式: 。
【思维拓展】
(1) 由上述实验可以推出,硫酸铜溶液显 (选填“酸”或“碱”)性。
(2) 不通过称量,如何判断SO2与NaOH溶液发生了反应呢?有一同学设计了右图所示的装置进行实验,发现试管内液面上升,就得出SO2与NaOH溶液发生反应的结论。其他同学认为这一方案不严谨,理由是 。要得到科学严谨的结论,仍利用该装置,补做的实验是 。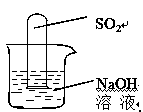
小明发现家中一枚戒指生满了铜绿,他和同学利用这枚戒指展开了研究性学习。
【查阅资料】真金在空气中不会生锈,生满铜绿的“金戒指”材质为铜锌合金;铜长期露置在潮湿的空气中能生成铜绿,其主要成分是碱式碳酸铜,碱式碳酸铜受热易分解生成CuO、H2O和CO2。据上述资料可推知,碱式碳酸铜由__________种元素组成。
【实验探究】将该枚戒指加入过量稀盐酸中,有气泡产生,溶液由无色逐渐变为蓝绿色。
(1)小明认为:气体中除了含有CO2,还可能含有少量__________。实验室常用__________的方法检验这种可能含有的气体。
(2)小红认为蓝绿色溶液中的溶质只有氯化锌。小华认为溶液中的溶质除了氯化锌外,还应该含有____________________。他取适量上述蓝绿色溶液,加入光亮的铁片,观察到了现象:①______________________________,②______________________________,证实了自己的观点。
(3)小娟取适量新制的FeCl2溶液,加入锌粒,一段时间后,溶液颜色变浅。结合小华的实验可推知:铁、锌、铜三种金属的活动性由弱到强的顺序是________________________________________。
某化学兴趣活动小组的同学学习“灭火器原理”后,设计了如下图所示实验,并对反应后锥形瓶中残留废液进行探究.
【提出问题】
废液中所含溶质是什么物质?
【猜想与假设】
猜想(一):废液中的溶质可能是NaCl、Na2CO3和HCl.
猜想(二):废液中的溶质只有NaCl.
猜想(三):废液中的溶质是NaCl和HCl.
猜想(四):废液中的溶质是.
【讨论与交流】
小明认为猜想(一)无需验证就知道是错误的.他的理由是.
【实验与结论】
(1)为验证猜想(二),小强同学取少量废液装入试管中,然后滴入AgNO3溶液,产生白色沉淀,滴加稀硝酸沉淀不溶解.于是小强认为猜想(二)正确.小强的实验(填“能”或“不能”)验证猜想(二)的正确性,原因是.
(2)若验证猜想(四)是否正确,下列试剂中可选用的有(填序号).
①氢氧化钠溶液 ②氯化钙溶液 ③稀盐酸 ④氯化钾溶液
某食品包装中防腐剂的主要成分是铁粉和生石灰,某化学兴趣小组对一包久置的这种防腐剂固体样品进行探究。
【提出问题】久置固体的成分是什么?
【查阅资料】常温下,铁与氯化铁在溶液中发生反应生成氯化亚铁。
【作出猜想】久置固体中可能含有Fe、Fe2O3、CaO、Ca(OH)2和CaCO3
【实验探究】方案一
| 实验操作 |
实验现象 |
解释或实验结论 |
| 取少量久置固体于试管中,加入足量的_________。 |
固体逐渐消失,有大量气泡产生,得到浅绿色溶液 |
固体中一定含有___ _,一定不含Fe2O3 |
有同学认为该方案并不能得出“一定不含Fe2O3”的结论,理由是:_____________________。
方案二:将久置固体研碎并用磁铁充分吸引,取剩余固体用足量蒸馏水溶解,过滤
| 实验操作 |
实验现象 |
解释或实验结论 |
| 1.取少量滤液于试管中,加入碳酸钠溶液 |
产生白色沉淀 |
反应的化学方程式是: ___________________ |
| 2.取滤渣于试管中,加入足量稀盐酸,将生成的气体通入澄清的石灰水 |
①固体逐渐消失,有大量气泡产生,得到黄色溶液 ②澄清的石灰水变浑浊 |
固体中一定含有______ |
【反思评价】通过以上实验,仍然不能确定是否含有的物质是______________________。
将稀盐酸、Na2CO3溶液、Ca(OH)2溶液倒入同一烧杯中,充分反应后过滤,得到固体A和滤液B。
请回答下列下列问题。
(1)得到的固体A是________。
(2)探究滤液B中是否含有Na2CO3:取少量滤液B,滴加足量稀盐酸,始终没有气泡冒出,由此得出结论:____________________。探究滤液B中是否含有CaCl2:取少量滤液B,滴加足量Na2CO3溶液,没有沉淀出现,由此得出结论:不含有CaCl2。这一探究同时说明滤液B中也不含有Ca(OH)2。
(3)综合分析可知:滤液B中一定含有的溶质是___________。
小明同学发现“旺旺雪饼”的包装袋内有一个“小纸袋”,上面写着“食品保鲜剂”,他很好奇,想和同学们对“食品保鲜剂”的成分进行探究。

【发现问题】“食品保鲜剂“的成分是什么?
【查阅资料】a.食品保鲜剂是利用其中的有效成分吸收空气中的氧气或水蒸气,防止食品变质;
b.初中阶段学习过的能吸收氧气或水蒸气的物质有:
①氢氧化钠 ②生石灰 ③铁粉 ④浓硫酸
【初步探究】同学们经过讨论,一致认为不可能是浓硫酸和氢氧化钠,理由是(1)_________________;同学们打开小纸袋.发现袋内固体为白色,则该保鲜剂的有效成分一定不是(2)_______;
【继续探究】同学们对袋内物质的成分继续探究:
步骤一:取少量样品于烧杯中,加入适量的水,搅拌,用温度计测温度,发现温度升高,该样品中一定含有的物质是(3)_________;
步骤二:过滤,向滤渣中加入足量稀盐酸,观察到的现象是(4)______________________,该样品中一定含有的物质是碳酸钙。向滤液中通入二氧化碳气体,溶液中出现白色浑浊,则该样品中一定含有氢氧化钙。此结论(5)______(填“正确”或“不正确”),理由是(6)______。
【拓展应用】食品保鲜剂除了能够吸收氧气或水蒸气外,还应具备一些要求,如:无毒、(7)________(写一点)等。