N2O5是一种新型硝化剂,在一定温度下可发生下列反应:
2N2O5(g)  4NO2(g)+O2(g) ΔH>0
4NO2(g)+O2(g) ΔH>0
T1温度下的部分实验数据为:
| t/s |
0 |
500 |
1000 |
1500 |
| c(N2O5)/mol·L-1 |
5.00 |
3.52 |
2.50 |
2.50 |
下列说法不正确的是
A.500 s内N2O5分解速率为2.96×10-3 mol·(L·s)-1
B.T1温度下的平衡常数为K1=125, 1000 s时转化率为50%
C.其他条件不变时,T2温度下反应到1000 s时测得N2O5(g)浓度为2.98 mol·L-1,则T1<T2
D.T1温度下的平衡常数为K1,T3温度下的平衡常数为K3,若K1>K3,则T1>T3
下列有关实验操作说法正确的是
| A.吸液时左手拿洗耳球右手持移液管;放液时应将移液管倾斜放入垂直放置的容器中 |
| B.用碱式滴定管量取23.10 mL 0.20 mol·L-1高锰酸钾溶液 |
| C.用10 mL量筒量取5.2 mL稀硫酸,仰视时实际量得的液体体积大于5.2 mL |
| D.钠、钾、白磷均应保存在煤油中,取用它们时要用镊子夹取 |
2013年6月20日,中国成为世界上第二个成功进行“太空授课”的国家。如图为太空授课中航天员用注射器向水球内注入空气,在水球内产生了 两个标准的球形气泡,气泡既没有被挤出水球也没有融合到一起,水球也没有爆裂。下列说法错误的是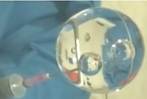
| A.实验是科学发现的重要手段,科学发现往往需要建立在实验事实的基础之上 |
| B.水的分子组成和结构,在太空中没有发生改变 |
| C.在太空实验中,如果往水球中分别注入氢气、氨气,同样也能观察到两个气泡 |
| D.水球实验中,可用吸水纸捕获洒落的水滴 |
用下图装置模拟人工肾脏的工作原理,电解生成的Cl2将尿素[CO(NH2)2]氧化成N2排出,则下列说法错误的是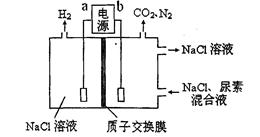
| A.电源的正极为b |
| B.尿素被氧化的化学方程式为CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl |
| C.电解结束后,阴极室溶液与电解前相比pH增大 |
| D.阳极收集到气体4.48 L(标准状况)时,被氧化的尿素为6.0 g |
在密闭容器中进行反应M(g)+N(g)  Y(g)+2Z(?),产物Y在平衡混合物中的质量分数(Y%)不同温度、压强条件下随时间的变化如图所示,则下列叙述正确的是
Y(g)+2Z(?),产物Y在平衡混合物中的质量分数(Y%)不同温度、压强条件下随时间的变化如图所示,则下列叙述正确的是
| A.正反应为放热反应,Z是气体 |
| B.正反应为放热反应,Z是固体或液体 |
| C.正反应为吸热反应,Z是气体 |
| D.正反应为吸热反应,Z是固体或液体 |
四种短周期元素在元素周期表中的位置如右图所示,其中Z的原子半径最小。下列说法正确的是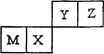
| A.M元素一定为金属元素 |
| B.X元素的最简单气态氢化物的热稳定性比Z元素的大 |
| C.若Y元素存在最高价含氧酸,其酸性比X元素的最高价含氧酸弱 |
| D.Z元素与氢元素一定能形成原子个数比为1︰1的共价化合物 |