工业合成氨与制备硝酸一般可连续生产,流程如下: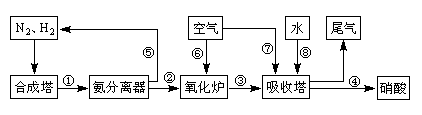
(1)工业生产时,制取氢气的一个反应为:CO+H2O(g) CO2+H2。t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=_____(填计算结果)。
CO2+H2。t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=_____(填计算结果)。
(2)合成塔中发生反应N2(g)+3H2(g) 2NH3(g) △H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1____300℃(填“>”、“<”或“=”)。
2NH3(g) △H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1____300℃(填“>”、“<”或“=”)。
| T/℃ |
T1 |
300 |
T2 |
| K |
1.00×107 |
2.45×105 |
1.88×103 |
(3)N2和H2在铁作催化剂作用下从145℃就开始反应,不同温度下NH3产率如图所示。温度高于900℃时,NH3产率下降的原因 。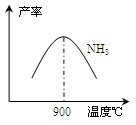
(4)在上述流程图中,氧化炉中发生反应的化学方程式为
__________ _。
(5)硝酸厂的尾气直接排放将污染空气。目前科学家探索利用燃料气体中的甲烷等将氮的氧化物还原为氮气和水,反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H= -574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H= -1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:________________________ 。
(6)氨气在纯氧中燃烧,生成一种单质和水,试写出该反应的化学方程式____________________,科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极是__________(填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为_______________________。
铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与H2SO4反应)。某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究。
Ⅰ.铁矿石中含氧量的测定
① 按上图组装仪器,检查装置的气密性;
② 将5.0g铁矿石放入硬质玻璃管中,装置B、C中的药品如图所示(夹持仪器均省略);
③从左端导气管口处不断地缓缓通入H2,待C装置出口处H2验纯后,点燃A处酒精灯;
④ 充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却。
(1)装置C的作用为。
(2)测的反应后装置B增重1.35g,则铁矿石中氧的百分含量为。
(3)若将H2换成CO,则还需补充装置。
Ⅱ.铁矿石中含铁量的测定
(1)溶液A中铁元素可能的存在形式;请从以下试剂中选择最佳试剂用最简单的实验验证A中铁元素的存在形式,试剂为:。
a.酸性KMnO4溶液 b.NaOH溶液 c.KSCN溶液 d.氯水
(2)步骤④中煮沸的作用是。
(3)步骤⑤中用到的玻璃仪器有:。
(4)下列有关步骤⑥的操作中说法正确的是。
a.因为碘水为黄色,所以滴定过程中不需加指示剂
b.滴定过程中可利用淀粉溶液作为指示剂
c.滴定管用蒸馏水洗涤后可以直接装液
d.锥形瓶不需要用待测夜润洗
e.滴定时,右手控制滴定管,左手摇动锥形瓶
f.滴定过程中,眼睛注视滴定管中液面变化
g.滴定结束后,待液面稳定后再读数
(5)若滴定过程中消耗0.5000mol·L−1的KI溶液20.00mL,则铁矿石中铁的百分含量为。
Ⅲ.由Ⅰ、Ⅱ可以推算出该铁矿石中铁的氧化物的化学式为。
有A、B、C、D、E、F六种元素,已知:它们位于三个不同的短周期,核电荷数依次增大;A与E、B与F分别同主族;A、E分别都能与D按原子个数1∶1或2∶1形成化合物;B、C分别能与D按原子个数1∶1或1∶2形成化合物。
(1)写出只含有A、B、D、E四种元素的两种无水盐的化学
式、。
(2)右图是A与D形成的一种化合物的晶体结构示意图,其中的虚线表示。E与D按原子个数比1∶1形成的化合物的电子式为。
(3)人们通常把拆开1mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。下表列出了上述部分元素形成的化学键的键能:
| 化学键 |
F—D |
F—F |
B—B |
F—B |
B==D |
D==D |
| 键能/ kJ·mol−1 |
460 |
176 |
347.7 |
347 |
745 |
497.3 |
①下列三种物质形成的晶体,熔点由高到低的顺序为(用a、b、c表示)。
a.F与B形成的化合物 b.B与D形成的稳定化合物
c.F的单质
②试写出F单质晶体的燃烧的热化学方程式:。
下列说法中,能说明化学平衡一定向正反应方向移动的是
A.N2O4(g)  2NO2(g),改变某一条件后,气体颜色加深 2NO2(g),改变某一条件后,气体颜色加深 |
B.N2(g) + 3H2(g)  2NH3(g),改变某一条件后,NH3的体积分数增加 2NH3(g),改变某一条件后,NH3的体积分数增加 |
C.H2(g) + I2(g)  2HI(g),单位时间内消耗H2和HI的物质的量之比大于1∶2 2HI(g),单位时间内消耗H2和HI的物质的量之比大于1∶2 |
D.2SO2(g) + O2(g)  2SO3(g),恒温恒压条件下,充入He 2SO3(g),恒温恒压条件下,充入He |
[化学——选修有机化学基础]
某水质稳定剂是由马来酸酐和乙酸乙烯酯聚合而成,可有效防止水垢的产生。
(1)马来酸酐可由马来酸分子内脱水制得。马来酸酐分子中含有五个原子构成的环状结构;马来酸的相对分子质量为116,实验式为CHO,其核磁共振氢谱显示有两个波峰,面积比为1 : 1。
① 马来酸的分子式为。
② 马来酸不能发生的反应是(填写序号)。
a. 加成反应 b. 氧化反应 c. 消去反应
d. 酯化反应 e. 水解反应 f. 加聚反应
③ 马来酸酐结构简式为。
(2)已知:Ⅰ. 在一定条件下,乙炔能分别与水、乙酸发生加成反应。
Ⅱ. 乙烯醇(CH2=CHOH)不能稳定存在,迅速转变成乙醛。 只用乙炔为有机原料合成乙酸乙烯酯(CH3COOCH=CH2),合成路线如下:
只用乙炔为有机原料合成乙酸乙烯酯(CH3COOCH=CH2),合成路线如下:
写出反应②、③的化学方程式:
②
③
(3)乙酸乙烯酯有多种同分异构体。与乙酸乙烯酯具有相同官能团且能发生银镜反应的同分异构体有种。
[化学—选修物质结构与性质]
纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域。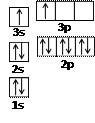 单位质量的A和B单质燃烧时均放出大量热,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
单位质量的A和B单质燃烧时均放出大量热,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
| 电离能(kJ/mol) |
I1 |
I2 |
I3 |
I4 |
| A |
932 |
1821 |
15390 |
21771 |
| B |
738 |
1451 |
7733 |
10540 |
(1)某同学根据上述信息,推断B的核外电子排布如右图所示,
该同学所画的电子排布图违背了。
(2)根据价层电子对互斥理论,预测A和氯元素形成的简单分子空间构型为。
(3)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为145~140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确,并阐述理由。 (4)科学家把C60和钾掺杂在一起制造了一种富勒烯化合物, 其晶胞如图所示,该物质在低温时是一种超导体。写出基态钾原子的电子排布式,该物质的K原子和C60分子的个数比为。
(4)科学家把C60和钾掺杂在一起制造了一种富勒烯化合物, 其晶胞如图所示,该物质在低温时是一种超导体。写出基态钾原子的电子排布式,该物质的K原子和C60分子的个数比为。
(5)继C60后,科学家又合成了Si60、N60,C、Si、N原子电负性由大到小的顺序是。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为。