已知2A2(g)+B2(g)  2C3(g);△H=-Q1 kJ/mol(Q1>0), 在一个有催化剂的固定容积的容器中加入2 molA2和1 molB2,在500℃时充分反应,达平衡后C3的浓度为w mol·L-1,放出热量为Q2 kJ。
2C3(g);△H=-Q1 kJ/mol(Q1>0), 在一个有催化剂的固定容积的容器中加入2 molA2和1 molB2,在500℃时充分反应,达平衡后C3的浓度为w mol·L-1,放出热量为Q2 kJ。
(1)达到平衡时, A2的转化率为________。
(2)达到平衡后,若向原容器中通入少量的氩气,A2的转化率将_____(填“增大“、“减小”或“不变”)
(3)若在原来的容器中,只加入2mol C3,500℃时充分反应达平衡后,吸收热量Q3kJ,C3浓度 (填>、=、<)w mol·L-1,Q1、Q2、Q3之间满足何种关系
(4)能说明该反应已经达到平衡状态的是 。
a.v(C3)="2" v (B2); b.容器内压强保持不变
c.2v逆(A2)=v正(B2) d.容器内的密度保持不变
(5)改变某一条件,得到如图的变化规律
(图中T表示温度,n表示物质的量),可得出的结论正确的是 ;
a.反应速率c>b>a
b.达到平衡时A2的转化率大小为:b>a>c
c.T2>T1
d.b点A2和B2的物质的量之比为2:1
(6)若将上述容器改为恒压容器(反应前体积相同),起始时加入2 molA2和l molB2,500℃时充分反应达平衡后,放出热量Q4 kJ,则Q2 Q4(填“>”、“<”或“=”)。
(7)下列措施可以同时提高反应速率和B2的转化率是(填选项序号) 。
a.选择适当的催化剂 b.增大压强
c.及时分离生成的C3 d.升高温度
(1)指出下列实验仪器和用品(已洗涤干净)使用时的第一步操作:
①淀粉碘化钾试 纸检验Cl2的性质;
纸检验Cl2的性质;
②分液漏斗(分液);
(2)下列有关实验的叙述中,合理的是(多选倒扣分)
| A.用碱式滴定管量取25.00mL溴水 |
| B.不宜用瓷坩埚灼烧氢氧化钠或碳酸钠 |
| C.测定溶液的pH值时用干燥、洁净的玻璃棒蘸取溶液,滴在用蒸馏水湿润过的pH试纸上,再与标准比色卡比较 |
| D.圆底烧瓶、锥形瓶、烧杯加热时都应垫在石棉网上 |
E.使用容量瓶配制溶液时,俯视刻度线定容后所得溶液浓度偏高
F.滴定用的锥形瓶和滴定管都要用所盛溶液润洗
G.配制硫酸溶液时,可先在量筒内加入一定体积的水,再在搅拌下慢慢加入浓硫酸
H.分液时,分液漏斗中下层液体从下口流出,上层液体从上口倒出
(3)卤素单质F2、Cl2、Br2、I2的熔沸点由高到低排列为,理由是;
卤化氢HF、HCl、HBr、HI中,沸点最低为,最高为,造成的原因为。
(12分)已知D是单质,其他均是常见 的化合物,它们之间的转化关系如下图所示,
的化合物,它们之间的转化关系如下图所示,
其中M(A)<M(B)。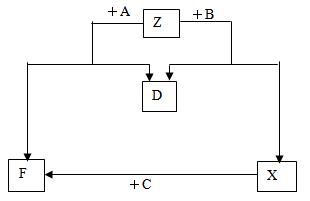
回答下列问题:
(1) 符合此转化关系的A、C的化学式分别是:A______________、C______________。
(2) 写出B的电子式:_______________,Z中阴阳离子数之比为:_____________。
(3) 若向X的水溶液中滴加几滴酚酞试液,现象是,
出现此现象的原因用离子方程式表示为,然后再加入足量的BaCl2溶液,出现的现象是,
原因是。
(4) 室温下,将2g苯和过量的D混合,完全燃烧,放出83.6kJ的热量,写出苯燃烧热的热化学方程式____________________________________________________。
请将5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上,组成一 个未配平的化学方程式。
个未配平的化学方程式。
(1)_________+__________ → __________+__________+__________+H2O
(2)反应物中发生氧化反应的物质,被还原的元素是。
(3)反应中1 mol氧化剂(填“得到”或“失去”)mol电子。
(4)请将反应物的化学式及配平后的系数填入下列相应的位置中:
某钠盐溶液可能含有阴离子NO3-、CO32-、SO32-、SO42-、Cl-、Br-、I一。为鉴定这些离子,分别取少量溶液进行以下实验:
①测得混合液呈碱性;
②加 HCl 后,生成无色无味气体。该气体能使饱和石灰水溶液变浑浊;
③加 CCl4,滴加少量氯水,振荡后, CCl4层未变色;
④加 BaCl2溶液产生白色沉淀,分离,在沉淀中加入足量盐酸,沉淀能完全溶解;
⑤加 HNO3酸化后,再加过量 AgNO3,溶液中析出白色沉淀。
(1)分析上述 5 个实验,写出每一实验鉴定离子的结论与理由。
实验①;
实验②;
实验③;
实验④ ;
;
实验⑤;
(2)上述 5 个实验不能确定是否存在的离子是。
(10分)有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的: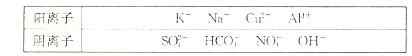
为了鉴别上述化合物。分别完成以下实验,其结果是:
①、将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②、将E溶液滴人到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③、进行焰色反应,只有B、C为紫色(透过蓝色钻玻璃);
④、在各溶液中加入硝酸钡溶液,再加过量稀硝酸,只有A中放出无色气体, C、D中产生
C、D中产生 白色沉淀;
白色沉淀;
⑤、 将B、D两溶液混合,未见沉淀或气体生成.
将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
(1)、写出B、D的化学式:B(2分),D (2分)。
(2)、将含1 mol A的溶液与含1 mol E的溶液反应后蒸干,仅得到一种化合物,该化合物的化学式为(2分)。
(3)、在A溶液中加少入量澄清石灰水,其离子方程式为(2分)。
(4)、C常用作净水剂,用离子方程式表示其净水原理(2分)。