某温度时,BaSO4在水中的沉淀溶解平衡曲线如下图所示。下列说法正确的是( )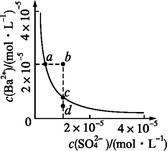
| A.加入Na2SO4可以使溶液由a点变到b点 |
| B.通过蒸发可以使溶液由d点变到c点 |
| C.d点无BaSO4沉淀生成 |
| D.a点对应的Ksp大于c点对应的Ksp |
某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示,据图分析,下列判断错误的是( )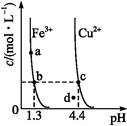
| A.Ksp[Fe(OH)3]<Ksp[Cu(OH)2] |
| B.加适量NH4Cl固体可使溶液由a点变到b点 |
| C.c、d两点代表的溶液中c(H+)与c(OH-)乘积相等 |
| D.Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和 |
在一定温度下,一定量的石灰乳悬浊液中存在下列平衡:Ca(OH)2(s) Ca(OH)2(aq)
Ca(OH)2(aq) Ca2+(aq)+2OH-(aq),当向此悬浊液中加入少量生石灰时,下列说法中正确的是( )
Ca2+(aq)+2OH-(aq),当向此悬浊液中加入少量生石灰时,下列说法中正确的是( )
| A.n(Ca2+)增大 | B.c(Ca2+)不变 | C.c(OH-)增大 | D.n(OH-)不变 |
溶度积常数表达式符合Ksp=·c(By-)的是( )
A.AgCl(s) Ag+(aq)+Cl-(aq) Ag+(aq)+Cl-(aq) |
B.Na2S 2Na++S2- 2Na++S2- |
C.Ag2S(s) 2Ag+(aq)+S2-(aq) 2Ag+(aq)+S2-(aq) |
D.PbI2(s) Pb2+(aq)+2I-(aq) Pb2+(aq)+2I-(aq) |
已知BaCO3、BaSO4溶度积常数分别为Ksp=5.1×10-9 mol2·L-2,Ksp=1.1×10-10 mol2·L-2,则BaSO4可作钡餐,BaCO3不能作钡餐的主要理由是( )
| A.BaSO4的溶度积常数比BaCO3的小 |
| B.S没有毒性,C有毒性 |
| C.BaSO4的密度大 |
| D.胃酸能与C结合,生成CO2和H2O,使BaCO3的溶解平衡向右移动,Ba2+浓度增大,造成人体Ba2+中毒 |