下列反应的离子方程式书写正确的是
| A.稀 H2SO4与铁粉反应:2Fe+6H+=2Fe3++3H2↑ |
| B.碳酸钙与盐酸反应:CO32—+2H+=H2O+CO2↑ |
| C.石英与烧碱溶液反应 SiO2+2OH-=SiO32-+H2O |
| D.氯化铜溶液与铁粉反应:Cu2++Fe=Fe3++Cu |
与CH2=CH2→CH2BrCH2Br的变化属于同一反应类型的是( )
A.CH3CHO→C2H5OHB.C2H5OH→CH2=CH2
下表所列各组物质中,物质之间通过一步反应不能实现如图所示转化的是( )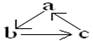
| 选项 |
a |
b |
c |
| A |
Fe |
FeCl3 |
FeCl2 |
| B |
HNO3 |
NO |
NO2 |
| C |
Al(OH)3 |
NaAlO2 |
Al2O3 |
| D |
NaOH |
NaHCO3 |
Na2CO3 |
某同学设计在KOH溶液中用铂作电极,利用CH3OH和O2的反应来构成原电池。下列说法正确的是( ):①正极上O2得到电子,发生还原反应②每消耗1molCH3OH可以向外电路提供6mole-③该电池的总反应为:2CH3OH+3O2=2CO2+4H2O④电池放电后,溶液的pH不断升高
| A.①② | B.①③ | C.②③ | D.③④ |
能正确表示下列反应的离子方程式的是( )
| A.浓烧碱溶液中加入铝片:Al+2OH-=AlO2-+ H2↑ |
| B.少量钠投入CuSO4溶液中:2Na+Cu2++2H2O=2 Na++Cu(OH)2↓+H2↑ |
| C.碳酸钙与盐酸反应:CO32-+2H+= H2O+CO2↑ |
| D.稀硫酸中加入铁粉:2Fe+6H+=2Fe3++3H2↑ |
用NA表示阿伏加德罗常数的数值,下列叙述正确的是( )
①常温常压下,17g甲基(-14CH3)所含中子数为8NA
②常温下,1L0.1 mol·L-1 Na2CO3溶液中阴离子数目之和大于0.1 NA
③常温常压下,0.3molCl2通入水中,充分反应后转移电子数目为0.3 NA
④250C,pH=13的NaOH溶液中含有OH-数目为0.1 NA
⑤标准状况下,22.4LSO3的分子数为NA
⑥标准状况下,22.4LNO和11.2L O2混合后气体的分子总数小于NA
| A.①②③ | B.①②⑥ | C.②④⑥ | D.③④⑤ |