X、Y、Z、W是原子序数依次增大的短周期元素,且互不同族;其中只有两种为金属;X原子的最外层电子数与次外层电子数相等;X与W、Y与Z这两对原子的最外层电子数之和均为9。单质Y和W都可与浓的NaOH溶液反应。下列说法不正确的是( )
| A.原子半径:Y>Z>W |
| B.非金属性最强的元素为W |
| C.Y的最高价氧化物对应的水化物为强酸 |
| D.XW2分子中各原子最外层电子均达到8电子结构 |
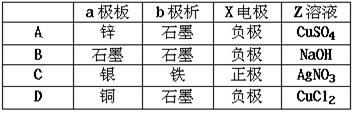
下图中x、y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无臭气体放出,符合这一情况的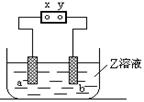
用石墨电极电解100mL H2SO4与CuSO4的混合液,通电一段时间后,两极均收集到2.24L(标况)气体,则原混合液中Cu2+的物质的量浓度为
| A.0.5mol/L | B.1mol/L | C.2mol/L | D.4mol/L |
白磷与氧可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:P—P akJ·mol—1、P—O bkJ·mol—1、P="O" ckJ·mol—1、O=O dkJ·mol—1。根据图示的分子结构和有关数据估算该反应的△H,其中正确的是
| A.(6a+5d-4c-12b)kJ·mol—1 | B.(4c+12b-6a-5d)kJ·mol—1 |
| C.(4c+12b-4a-5d)kJ·mol—1 | D.(4a+5d-4c-12b)kJ·mol—1 |
Fe2O3(s)+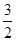 C(s)===
C(s)===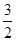 CO2(g)+2Fe(s) ΔH1=+234.1 kJ/mol;C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ/mol;则2Fe(s)+
CO2(g)+2Fe(s) ΔH1=+234.1 kJ/mol;C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ/mol;则2Fe(s)+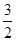 O2(g)===Fe2O3(s)的ΔH是
O2(g)===Fe2O3(s)的ΔH是
| A.-627.6 kJ/mol | B.-824.4 kJ/mol |
| C.-744.7 kJ/mol | D.-169.4 kJ/mol |
下列反应属于吸热反应的是
①二氧化碳与赤热的炭反应生成一氧化碳
②液态水汽化
③锌粒与稀H2SO4反应制取H2
④Ba(OH)2·8H2O固体与NH4Cl固体反应
⑤生石灰跟水反应
| A.①②④ | B.①⑤ | C.①③④⑤ | D.①④ |