Fe2O3(s)+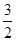 C(s)===
C(s)===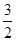 CO2(g)+2Fe(s) ΔH1=+234.1 kJ/mol;C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ/mol;则2Fe(s)+
CO2(g)+2Fe(s) ΔH1=+234.1 kJ/mol;C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ/mol;则2Fe(s)+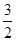 O2(g)===Fe2O3(s)的ΔH是
O2(g)===Fe2O3(s)的ΔH是
| A.-627.6 kJ/mol | B.-824.4 kJ/mol |
| C.-744.7 kJ/mol | D.-169.4 kJ/mol |
下列反应的离子方程式正确的是
A.NaHCO3溶液与盐酸:CO32−+ 2H+ H2O + CO2↑ H2O + CO2↑ |
B.Ca(HCO3)2溶液与过量NaOH溶液:Ca2+ + HCO3−+ OH− H2O + CaCO3↓ H2O + CaCO3↓ |
C.用醋酸溶液除水垢:2CH3COOH + CaCO3 Ca2+ + 2CH3COO−+ H2O + CO2↑ Ca2+ + 2CH3COO−+ H2O + CO2↑ |
| D.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至呈中性: |
H+ + SO42−+ Ba2+ + OH− H2O + BaSO4↓
H2O + BaSO4↓
用NA表示阿伏伽德罗常数的值,下列说法正确的是
| A.在标准状况下,2.24LH2O中所含分子数为0.1NA |
| B.32g氧气和32g臭氧(O3)所含原子数均为2NA |
| C.在常温常压下,2.24LNH3所含质子数为10NA |
| D.1mol CO2和1mol CO均含有NA个分子,则所占体积也相同 |
某无色溶液中能够大量存在的离子是
| A.K+ H+ SO42- OH- |
| B.Na+ Ca2+ CO32- NO3- |
| C.Mg2+ Fe3+ NO3- SO42- |
| D.Na+ Mg2+ Cl- SO42- |
下列溶液中的Cl-浓度与50mL1 mol•L-1的AlCl3溶液中Cl-的浓度相等的是
| A.75mL1.5mol•L-1的CaCl2 |
| B.75mL2mol•L-1的NH4Cl |
| C.150mL1.5mol•L-1的KCl |
| D.150mL1mol•L-1的NaCl |
下列叙述中错误的是
| A.H2SO4的摩尔质量是98 |
| B.等质量的O2和O3中所含氧原子个数相同 |
| C.等物质的量的CO和CO2中所含碳原子数相等 |
| D.2molNO和2mol NO2含原子数不同 |