已知在1×105 Pa,298 K条件下,2mol氢气燃烧生成水蒸气放出484 kJ热量,下
列热化学方程式正确的是
A.H2O(g)= H2(g)+ O2 (g)△H =+242 kJ/mol O2 (g)△H =+242 kJ/mol |
| B.2H2(g)+ O2 (g)= 2H2O (l)△H =-484 kJ/mol[来 |
C.H2 (g)+  O2 (g) O2 (g) = H2O = H2O (l)△H =-242 kJ/mol (l)△H =-242 kJ/mol |
| D.2H2 (g)+ O2 (g)= 2H2O (g)△H =+484 kJ/mol |
下列说法不正确的是
A.钢铁发生电化学 腐蚀时,负极发生的反应是2H2O+O2+4e-=" 4" OH- 腐蚀时,负极发生的反应是2H2O+O2+4e-=" 4" OH- |
| B.在空气中,金属铝表面能迅速被氧化形成保护膜,因此铝不容易被腐蚀 |
| C.铸铁输油管道应埋在干燥致密不透气的土壤中 |
| D.白铁(镀Zn铁)表面有划损时,也能阻止铁被氧化 |
有人设计出利用CH 和
和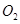 的反应,用铂电极在KOH溶液中构成原电池。电池的总反应类似于
的反应,用铂电极在KOH溶液中构成原电池。电池的总反应类似于 在
在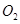 中燃烧,则下列说法正确的是
中燃烧,则下列说法正确的是
①每消耗lmolCH4可以向外电路提供8mole ②负极上
②负极上 失去电子,电极反应式
失去电子,电极反应式 ③负极上是O
③负极上是O 获得电子,电极反应式为
获得电子,电极反应式为 ④电池放电后溶液pH不断升高
④电池放电后溶液pH不断升高
| A.①② | B.①③ | C.①④ | D.③④ |
在4L密闭容器中充入6molA气体和5molB气体,在一定条件下发生反应:3A(g)+B(g) 2C(g)+xD(g),5s达到平衡。达到平衡时,生成了2molC,经测定D的浓度为0.5mol/L,下列判断正确的是
2C(g)+xD(g),5s达到平衡。达到平衡时,生成了2molC,经测定D的浓度为0.5mol/L,下列判断正确的是
| A.x="1" | B.B的转化率为20% |
| C.平衡时A的浓度为1.50mol/L | D.B的平均反应速率为0.2 mol/(L·s) |
下列叙述正确的是
| A.碱性锌锰干电池的负极材料为二氧化锰 |
| B.碱性氢氧燃料电池工作时负极反应为:H2-2e-+2OH-=2H2O |
| C.铅蓄电池放电时负极反应为:PbO2+2e-+4H+=Pb2+++2H2O |
| D.锌一铜一稀硫酸构成的原电池工作时,H+向负极移动 |